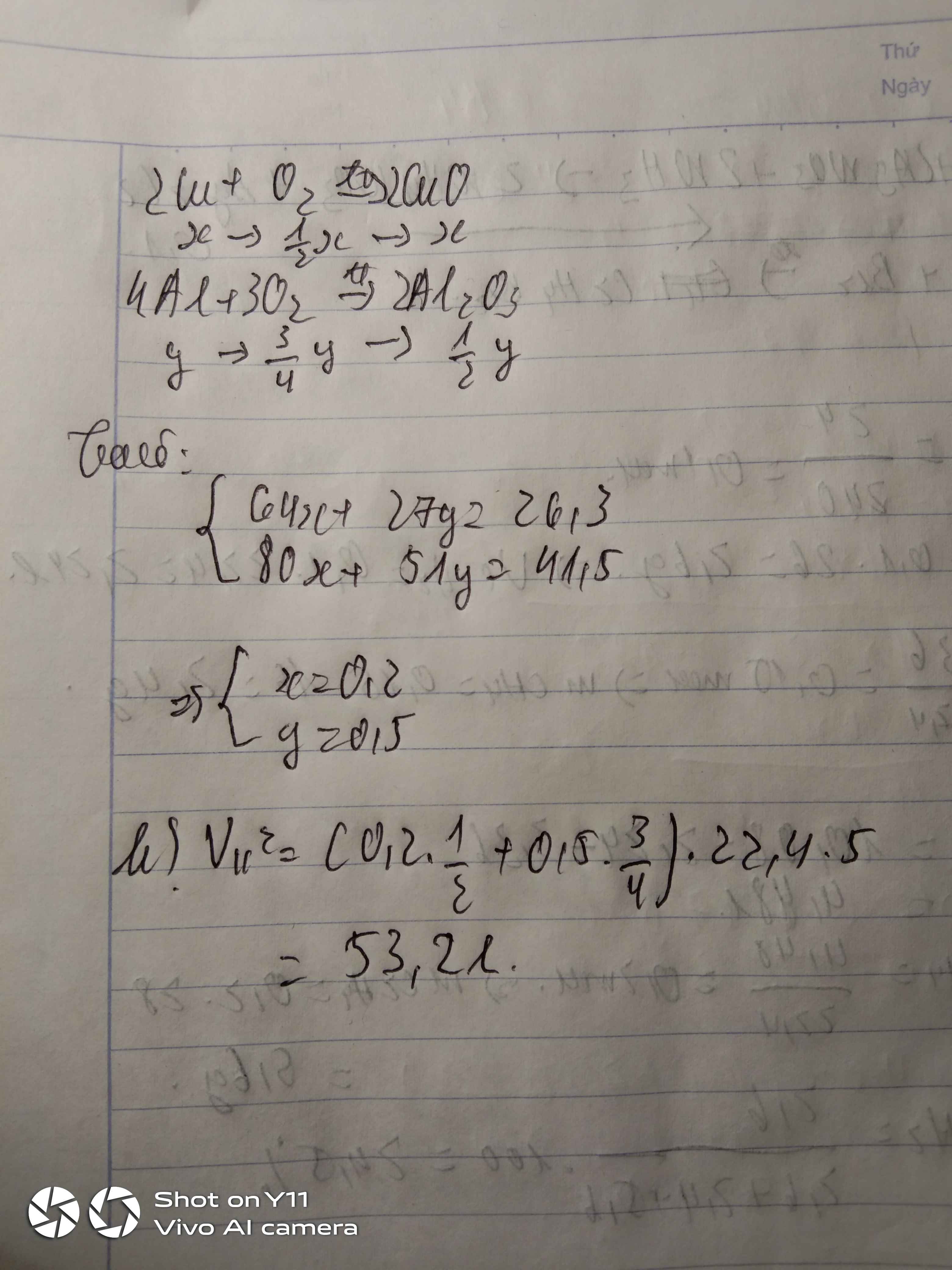Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a,PTHH:2Cu+O_2\xrightarrow{t^o}2CuO\\ n_{Cu}=\dfrac{11,52}{64}=0,18(mol)\\ b,n_{CuO}=n_{Cu}=0,18(mol)\\ \Rightarrow m_{CuO}=0,18.80=14,4(g)\\ c,n_{O_2}=0,5.n_{Cu}=0,09(mol)\\ \Rightarrow V_{O_2}=0,09.22,4=2,016(l)\\ \Rightarrow V_{kk}=2,016.5=10,08(l)\)

\(a)2Cu+O_2\xrightarrow[]{t^0}2CuO\)
\(b)n_{CuO}=a;n_{Cu\left(dư\right)}=b\\ 80.20\%a-64b=0\left(1\right)\\ n_{Cu\left(PƯ\right)}=n_{CuO}=a\\ 64a+64b=33,6\left(2\right)\\ \left(1\right)\&\left(2\right)\Rightarrow a=0,42;b=0,105\\ m_{Cu\left(pư\right)}=0,42.64=26,88g\\ n_{O_2}=\dfrac{1}{2}\cdot0,42=0,21mol\\ m_{O_2}=0,21.32=6,72g\\ c)m_{kk}=6,72:20\%=33,6g\)

PTHH: \(2Cu+O_2\underrightarrow{t^o}2CuO\)
Ta có: \(n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)=n_{Cu\left(p/ư\right)}\)
\(\Rightarrow n_{Cu\left(dư\right)}=\dfrac{12,8}{64}-0,15=0,05\left(mol\right)\)
\(\Rightarrow n_{O_2\left(cầnthêm\right)}=0,025mol\) \(\Rightarrow V_{O_2\left(thêm\right)}=0,025\cdot22,4=0,56\left(l\right)\)
\(n_{Cu} = \dfrac{12,8}{64} = 0,2(mol)\\ n_{CuO} = \dfrac{12}{80} = 0,15(mol)\\ 2Cu + O_2 \xrightarrow{t^o} 2CuO\)
Ta thấy : nCu = 0,2 > nCuO = 0,15 nên Cu dư.
Theo PTHH : \(n_{O_2\ } = \dfrac{1}{2}n_{CuO} = 0,075(mol)\)
Nếu đốt cháy hết lượng Cu ban đầu thì cần \(n_{O_2} = \dfrac{1}{2}n_{Cu} = 0,1(mol)\)
Suy ra :
\(n_{O_2\ cần\ thêm} = 0,1 - 0,075 = 0,025(mol)\\ \Rightarrow V_{O_2} = 0,025.22,4 = 0,56(lít)\)

a: \(4Al+3O_2\rightarrow2Al_2O_3\)
b: \(n_{Al}=\dfrac{21.6}{27}=0.8\left(mol\right)\)
\(\Leftrightarrow n_{Al_2O_3}=0.4\left(mol\right)\)
\(m_{Al_2O_3}=0.4\cdot102=40.8\left(g\right)\)
c: \(n_{O_2}=0.6\left(mol\right)\)
\(V_{O_2}=0.6\cdot22.4=13.44\left(lít\right)\)
a) 4Al + 3O2 --to--> 2Al2O3
b) \(n_{Al}=\dfrac{21,6}{27}=0,8\left(mol\right)\)
PTHH: 4Al + 3O2 --to--> 2Al2O3
0,8-->0,6-------->0,4
=> \(m_{Al_2O_3}=0,4.102=40,8\left(g\right)\)
c) \(V_{O_2}=0,6.22,4=13,44\left(l\right)\)
d) \(V_{kk}=13,44:20\%=67,2\left(l\right)\)

a) PTHH: 2Cu + O2 ==(nhiệt)=> 2CuO
b) nCu = 6,4 / 64 = 0,1 (mol)
=> nO2 = 0,05 (mol)
=> VO2(đktc) = 0,05 x 22,4 = 1,12 lít
c) nCuO = nCu = 0,1 (mol)
=> mCuO = 0,1 x 80 = 8 (gam)
a) 2Cu + O2 ---> 2CuO
b) nCu = 6,4/64 =0,1 ( mol )
Theo PTHH : nO2 = 1/2 nCu = 0,1/2=0,05( mol )
VO2 = 0,05 x 22.4 = 1,12 ( l )
c)Theo PTHH : nCuO = nCu = 0,1 ( mol)
Khối lượng đồng oxit thu được sau phản ứng là : mCuO = 0,1 x 80 = 8 (g)

a) \(4Al+3O_2-^{t^o}\rightarrow2Al_2O_3\)
Bảo toàn khối lượng : \(m_{O_2}=12,24-8,1=4,14\left(g\right)\)
=>\(n_{O_2}=\dfrac{207}{1600}\left(mol\right)\)
Vì O2 chiếm 20% thể tích không khí
\(V_{kk}=\dfrac{\dfrac{207}{1600}.22,4}{20\%}=14,49\left(lít\right)\)
b) \(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
Lập tỉ lệ : \(\dfrac{0,3}{4}>\dfrac{\dfrac{207}{1600}}{3}\)
=> Sau phản ứng Al dư
\(n_{Al\left(pứ\right)}=\dfrac{207}{1600}.\dfrac{4}{3}=0,1725\left(mol\right)\)
=> \(H=\dfrac{0,1725}{0,3}.100=57,5\%\)
c) D gồm Al2O3 và Al dư
\(n_{Al_2O_3}=\dfrac{2}{3}n_{O_2}=\dfrac{69}{800}\left(mol\right);n_{Al\left(dư\right)}=0,3-0,1725=0,1275\left(mol\right)\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(\Sigma n_{HCl}=\dfrac{69}{800}.6+0,1275.3=0,9\left(mol\right)\)
=> \(m_{HCl}=0,9.36,5=32,85\left(g\right)\)

Gọi số mol CuO phản ứng là a (mol)
\(n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
a--->a---------->a
=> 80(0,25-a) + 64a = 16,8
=> a = 0,2 (mol)
=> \(H\%=\dfrac{0,2}{0,25}.100\%=80\%\)
V = 0,2.22,4 = 4,48 (l)
Chất rắn thu được gồm Cu và CuO, khối lượng chất rắn giảm bằng khối lượng oxi mất đi do CO khử.
mOpư=20-16,8=3,2 (g), nOpư=0,2 (mol). Lượng CuO ban đầu là 20/80=0,25 (mol).
Hiệu suất phản ứng là (0,2/0,25).100%=80%.
Lượng CO đã phản ứng bằng lượng nguyên tử O phản ứng và bằng 0,2 mol.
CO + CuO \(\underrightarrow{t^o}\) Cu + CO2
Thể tích khí CO đã dùng là 0,2.22,4=4,48 (l).