Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

đây ạ
nFe = 8.4/56=0.15 mol
nCu = 6.4/64=0.1 mol
nAgNO3 = 0.35*2=0.7 mol
Fe + 2AgNO3 --> Fe(NO3)2 + 2Ag
0.15___0.3________0.15_____0.3
Cu + 2AgNO3 --> Cu(NO3)2 + 2Ag
0.1____0.2________0.1_______0.2
nAgNO3( còn lại ) = 0.7 - 0.3 - 0.2 = 0.2 mol
Vì : AgNO3 còn dư nên tiếp tục phản ứng với Fe(NO3)2
Fe(NO3)2 + AgNO3 --> Fe(NO3)3 + Ag
Bđ: 0.15________0.2
Pư: 0.15________0.15_______________0.15
Kt: 0___________0.05_______________0.15
Chất rắn : 0.65 (mol) Ag
mAg = 0.65*108 = 70.2g

1) Ptpư:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Cu + HCl \(\rightarrow\) không phản ứng
=> 0,6 gam chất rắn còn lại chính là Cu:
Gọi x, y lần lượt là số mol Al, Fe
Ta có:
3x + 2y = 2.0,06 = 0,12
27x + 56 y = 2,25 – 0,6 = 1,65
=> x = 0,03 (mol) ; y = 0,015 (mol)
=> \(\%Cu=\frac{0,6}{2,25}.100\%=26,67\%\); \(\%Fe=\frac{56.0,015}{2,25}.100\%=37,33\%\); %Al = 36%
2) \(n_{SO_2}=\frac{1,344}{22,4}=0,06mol\); m (dd KOH) = 13,95.1,147 = 16 (gam)
=> mKOH = 0,28.16 = 4,48 (gam)=> nKOH = 0,08 (mol)=> \(1<\)\(\frac{n_{KOH}}{n_{SO_2}}<2\)
=> tạo ra hỗn hợp 2 muối: KHSO3: 0,04 (mol) và K2SO3: 0,02 (mol)
Khối lượng dung dịch sau pu = 16 + 0,06.64 = 19,84 gam
=> \(C\%\left(KHSO_3\right)=\frac{0,04.120}{19,84}.100\%\)\(=24,19\%\)
\(C\%\left(K_2SO_3\right)=\frac{0,02.158}{19,84}.100\%\)\(=15,93\%\)

Có thể xem công thức Fe3O4 là FeO.Fe2O3 nên hỗn hợp X có thể được xem như gồm FeO và Fe2O3.
Gọi a là số mol FeO, b là số mol Fe2O3 của 0,5 m gam X.
FeO + H2SO4 --->FeSO4 + H2O
Fe2O3 + 3H2SO4 ---> Fe2(SO4)3 + 3H2O
từ khối lượng muối khan ở phần 1, ta có phương trình
152a + 400b = 31,6 gam (1)
Phần 2 khi cho Cl2 vào thì xảy ra pu:
FeSO4 + 0,5 Cl2 ---> 1/3 Fe2(SO4)3 + 1/3 FeCl3
--> khối lượng muối ở phần 2 = 400a/3 + 162,5a/3 + 400b = 33,375 gam
--> 562a + 1200b = 100,125 (2)
Từ (1) và (2) suy ra :
a =0,0502358 mol
b = 0,0599153 mol
--> Khối lượng hỗn hợp X = 2 x (72 x 0,0502358 + 160 x 0,0599153) = 26,712448 gam
a.
Phương trình
+ Khi hòa A bằng axit H2SO4 loãng
FeO + H2SO4 \(\rightarrow\) FeSO4 + H2O (1)
Fe2O3 + 3H2SO4 \(\rightarrow\) Fe2(SO4)3 + 3H2O (2)
Fe3O4 + 4H2SO4 \(\rightarrow\) Fe2(SO4)3 + FeSO4+ 3H2O (3)
Sau phản ứng dung dịch chỉ có 2 muối (x+z)mol FeSO4 và (y+z) mol Fe2(SO4)3
+ Khi sục khí Cl2 vào dung dịch sau phản ứng chỉ có FeSO4 phản ứng
6FeSO4 + 3Cl2 \(\rightarrow\) 2FeCl3 + 2Fe2(SO4)3 (4)
b.
Theo bài ta có hệ phương trình
\(\begin{cases}72x+160y+232z=m\text{/}2\\152\left(x+z\right)+400\left(y+z\right)=31,6\\187,5\left(x+z\right)+400\left(y+z\right)=33,375\end{cases}\)\(\begin{matrix}\left(I\right)\\\left(II\right)\\\left(III\right)\end{matrix}\)
Từ II, III ta có x+z= 0,05; y+z=0,06
Mặt khác từ I ta có m=2.[ 72(x+z) + 160(y+z)]=26,4 gam
Vậy m= 26,4g
\(C_{FeSO_4}\)=0,2M; \(C_{Fe_2\left(SO_4\right)_3}\)=0,24M

Đáp án C
Vì khi thêm HCl thì khối lượng chất rắn khan thu được tăng lên nên ở lần 1 kim loại phản ứng dư và HCl hết, lần 1 có
![]() nếu ở lần 2 kim loại vẫn dư và HCl hết thì tổng số mol HCl 2 lần là 0,36 + 0,24 = 0,6
nếu ở lần 2 kim loại vẫn dư và HCl hết thì tổng số mol HCl 2 lần là 0,36 + 0,24 = 0,6
Mà 2 lần có ![]()
nên lần 2 kim loại đã phản ứng hết.


Đáp án D.
Chất rắn không tan là Cu.
![]()
Zn + 2HCl → ZnCl2 + H2
0,2 ← 0,2 (mol)
mZn = 0,2.65 = 13 (g) => mCu = 15 – 13 = 2 (g)

Đáp án A
Fe + 2H+ → Fe2++ H2
Fe + Cu2+ → Fe2++ Cu
![]() = 0,25(mol)
= 0,25(mol)
Bảo toàn khối lượng: ![]()
m + 64.0,15 + 0,2 = 0,725m + 2.0,1 + 56.0,25
⇒ m = 16g

Hòa tan hoàn toàn 15,2 gam hỗn hợp gồm Fe và Cu trong dung dịch HNO3, thu được dung dịch X và 4,48 lút khí NO. Cho 3,96 gam kim loại Mg vào X đến khi phản ứng xảy ra hoàn toàn, thu được 224ml khí NO và m gam chất rắn không tan. biết NO là sản phẩm khử duy nhất của N+5. Gía trị cảu m là
A. 6,4 B.12,8 C.9,6 D.4,8
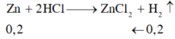
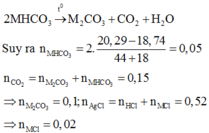
Tính số mol từng chất trong hỗn hợp và số mol dd. Viết pt Al + AgNO3 trước ( vì Al mạnh hơn Fe ) . Tính số mol AgNO3 đã phản ứng. Phần còn lại sẽ phản ứng với Fe. Chất rắn còn lại gồm Ag sinh ra và có thể còn Fe dư