Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1 : Cho 11,2 gam Fe tác dụng với lượng dư dung dịch HCl thu được V lít khí đktc ? Tính V .
Ta có : n Fe = 11,2 : 56 = 0,2 ( mol )
Ta có phương trình phản ứng :
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo phương trình : 1 mol Fe phản ứng tạo ra 1 mol khí hidro .
Theo bài ra : 0,2 mol Fe phản ứng tạo ra 0,2 mol khí hidro .
\(\Rightarrow V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\)
Vậy V = 4,48 lít .

a, PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\)
b, Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{MgO}=y\left(mol\right)\end{matrix}\right.\)
⇒ 24x + 40y = 4,4 (1)
Ta có: \(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}=x\left(mol\right)\)
⇒ x = 0,1 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Mg}=\dfrac{0,1.24}{4,4}.100\%\approx54,54\%\\\%m_{MgO}\approx45,46\%\end{matrix}\right.\)
c, Theo PT: \(\Sigma n_{HCl}=2n_{Mg}+2n_{MgO}=0,3\left(mol\right)\)
\(\Rightarrow V_{HCl}=\dfrac{0,3}{2}=0,15\left(l\right)=150\left(ml\right)\)
Bạn tham khảo nhé!

\(a,PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ b,n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\\ n_{HCl}=2\cdot0,15=0,3\left(mol\right)\)
Vì \(\dfrac{n_{Zn}}{1}>\dfrac{n_{HCl}}{2}\) nên sau p/ứ Zn dư
\(\Rightarrow n_{Zn}=\dfrac{1}{2}n_{HCl}=0,15\left(mol\right)\\ \Rightarrow m_{Zn}=0,15\cdot65=9,75\\ \Rightarrow m_{Zn\left(dư\right)}=13-9,75=3,25\left(g\right)\\ c,n_{H_2}=n_{Zn}=0,15\left(mol\right)\\ \Rightarrow V_{H_2}=0,15\cdot22,4=3,36\left(l\right)\)

a)
$Fe + 2HCl \to FeCl_2 + H_2$
$FeO + 2HCl \to FeCl_2 + H_2O$
b)
Theo PTHH : $n_{Fe} = n_{H_2} = \dfrac{3,36}{22,4} = 0,15(mol)$
$m_{Fe} = 0,15.56 = 8,4(gam)$
$m_{FeO} = 12 - 8,4 = 3,6(gam)$
$n_{FeO} =0,05(mol)$
Theo PTHH : $n_{HCl} = 2n_{Fe} + 2n_{FeO} = 0,4(mol)$
$V_{dd\ HCl} = \dfrac{0,4}{2} = 0,2(lít)$
c) $Fe + CuSO_4 \to FeSO_4 + Cu$
$n_{Cu} = n_{Fe} = 0,15(mol) \Rightarrow m_{chất\ rắn} = m_{FeO} + m_{Cu}$
$= 3,6 + 0,15.64 = 13,2(gam)$

1)
$MgO + 2HCl to MgCl_2 + H_2O$
$Mg + 2HCl \to MgCl_2 + H_2$
2)
$n_{Mg} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)$
$m_{Mg} = 0,1.24 = 2,4(gam)$
$m_{MgO} = 4,4 - 2,4 = 2(gam)$
3)
$n_{HCl} = 2n_{Mg} + 2n_{MgO} = 0,1.2 + \dfrac{2}{40}.2 = 0,3(mol)$
$V_{dd\ HCl} = \dfrac{0,3}{2} = 0,15(lít) = 150(ml)$

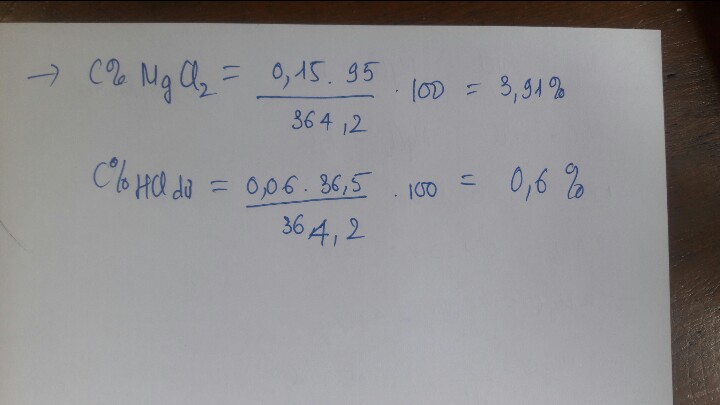
11,3 gam hỗn hợp \(\left\{{}\begin{matrix}Mg:a\left(mol\right)\\Zn:b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow24a+65b=11,3\left(I\right)\)
Cho hỗn hợp trên qua HCl lấy dư:
Ta có: \(\left\{{}\begin{matrix}n_{HCl}=0,4.2=0,8\left(mol\right)\\n_{H_2}\left(đktc\right)=\dfrac{6,72}{22,4}=0,3\left(mol\right)\end{matrix}\right.\)
\(Mg\left(a\right)+2HCl\left(2a\right)\rightarrow MgCl_2\left(a\right)+H_2\left(a\right)\)
\(Zn\left(b\right)+2HCl\left(2b\right)\rightarrow ZnCl_2\left(b\right)+H_2\left(b\right)\)
Theo PTHH: \(\sum n_{H_2}=a+b\left(mol\right)\)
\(\Rightarrow a+b=0,3\left(II\right)\)
Giai (I) và II) => a = 0,2 (mol); b = 0,1 (mol)
\(\sum n_{HCl}\left(pư\right)=2n_{H_2}=0,6\left(mol\right)\)
\(\Rightarrow n_{HCl}\left(dư\right)=0,8-0,6=0,2\left(mol\right)\)
Vậy dung dịch A thu được sau phản ứng gồm: \(\left\{{}\begin{matrix}MgCl_2:0,2\left(mol\right)\\ZnCl_2:0,1\left(mol\right)\\HCl\left(dư\right):0,2\left(mol\right)\end{matrix}\right.\)
\(Vddsau=VddHCl=0,4\left(l\right)\)
Nồng độ mol các chất có trong dung dịch A:
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{MgCl_2}}=\dfrac{0,2}{0,4}=0,5\left(M\right)\\C_{M_{ZnCl_2}}=\dfrac{0,1}{0,4}=0,25\left(M\right)\\C_{M_{HCl}}\left(dư\right)=\dfrac{0,2}{0,4}=0,5\left(M\right)\end{matrix}\right.\)