Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)\(m_{ngtu}=m_p+m_n+m_e=1,67.10^{-27}.6+1,67.10^{-27}+9,1.10^{-31}.6\\ =2.10^{-26}\left(kg\right)=12u\)\(\dfrac{m_{electron}}{m_{ngtu}}=\dfrac{9,1.10^{-31}.6}{2.10^{-26}}=2,73.10^{-4}\)
b)
\(m_{ngtu}=11.1,67.10^{-27}+12.1,67.10^{-27}+9,1.10^{-31}.11\\ =3,842.10^{-26}\left(kg\right)=\dfrac{3,842.10^{-26}}{1,6605.10^{-27}}u=23u\)

Nguyên tử khối trung bình của Al là:
¯AAl=27.23+29.2\23+2=27,16
%27\13Al=23\23+2.100%=92%
% theo khối lượng của trong phân tử Al2X3 là 33,05%
27.2\27,16.2+3.MX.92%=33,05% → MX= 32

1.
a) Gọi p là số proton của nguyên tố X
Đồng vị X1 có 3 loại hạt bằng nhau nên 3p = 18 suy ra p = 6
Đồng vị X2 có tổng số hạt 20 nên 2p + n’ = 20 suy ra n’ = 8
Số khối của các đồng vị X1, X2 lần lượt là 12, 14
Phần trăm hai đồng vị bằng nhau suy ra mỗi đồng vị chiếm 50%
Atb = (12.50 + 14.50) / 100 = 13 đvC
b)
Gọi số khối của hai đồng vị X, Y là A1 và A2; phần trăm số nguyên tử của hai đồng vị này là x1 và x2. Theo giả thiết ta có:
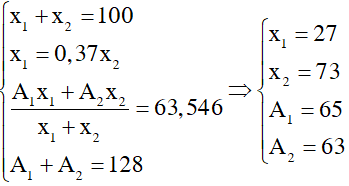
1
a , các loại hạt trong X1 bằng nhau <=> p=n1=e=6 (hạt) => A1 = 12
=> n2 = 20-6.12=8(hạt) => A2 = 8+6=14
%X1 = %X2 = 50%
\(\overline{\text{A}}=\frac{14.50+12.50}{100}=13\)
2 , gọi 2 đồng vị A1p Y và A2p Z , phần trăm của 2 đồng vị lần lượt la x1 , x2
Theo bài ra
A1 + A2 =128
x1 + x2 = 100
\(\overline{M}=\frac{A_1x_1+A_2x_2}{100}=\) 63,54
x1 - 0,37x2 = 0
=> A1 = 65 , A2 = 63

Nguyên tử khối trung bình của nguyên tố cacbon là :
M = \(\frac{12.98,89+13.1,11}{100}=12,011\)
→ Chọn B

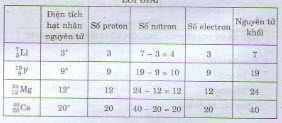
bạn nên chia ra từng bài nhỏ đề dễ nhìn nha