Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Ở phần 1 khi cho tác dụng với NaOH có sinh ra khí H2 => nhôm dư
Phần 1
nH2 = 0,0525 mol => nAl dư = 0,035 mol
chất rắn không tan tác dụng với HCl => nH2 = 0,045 mol => nFe = 0,045 mol
Phần 2
nH2 = 0,2925 mol
Giả sử phần 2 = k. phần 1
Bảo toàn e ở phần 2 ta có (3 . 0,035 + 2 . 0,045) . k = 2 . 0,2925 => k = 3
Có mA = mB = 4 khối lượng phần 1
=> tổng lượng H2 ở thí nghiệm 1 = 4 . (0,0525 + 0,045 ) = 0,39
=> nFe3O4 = (4 . 0,045) : 3 = 0,06 mol
=> 3nAl = 2.nFe3O4 + 2nH2 => nAl = 0,3 mol
=> mA = 0,3 . 27 + 0,06 . 232 = 22,02 mol
%Al = 37% và %Fe3O4 = 63%
Đáp án A

Đáp án B
Do P2 tác dụng với NaOH sinh ra H2 => Al dư sau phản ứng nhiệt nhôm => Y gồm Al dư, Fe, Al2O3
+P2: nAl dư=nH2/1,5=0,075 mol;
Chất rắn là Fe: nFe=8,4/56=0,15 mol
=>nAl/nFe=1/2
+ P1: Giả sử số mol
Al dư: x
Fe: 2x
BT e: 3nAl+3nFe=3nNO=>3x+3.2x=3.0,075=>x=0,025 mol
=>mAl2O3=6,025-0,025.27-0,05.56=2,55 g=>nAl2O3=0,025 mol
=>nO=3nAl2O3=0,075 mol
=>nFe/nO=0,05/0,075=2/3 (Fe2O3)
m=4mP1=6,025.4=24,1 gam

Số mol H2 tạo ra khi B + NaOH = 0,375 mol là do Al dư.
=> Số mol al dư = 0,375.2/3 = 0,25 mol.
Số mol H2 tạo ra khi D + HCl = 0,8 mol là do Fe tạo ra sau pư nhiệt nhôm
=> Số mol Fe = 0,8.2/2 = 0,8 mol.
Rắn B gồm Al2O3, Al dư và Fe
=> Số mol Al2O3 = (92,35 - 0,25. 27 - 0,8. 56)/102 = 0,4 mol
=> Số mol O trong oxit = 0,4. 3 = 0,12 mol
=> nFe : nO = 0,8: 0,12 = 2: 3 => Oxit sắt là Fe2O3
Hỗn hợp đầu có Al: 0,4. 2+ 0,25 = 1,05 mol và Fe2O3: 0,8/2 =0,4 mol

Đáp án C
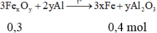
· Phần 2: + NaOH ® 0,015 mol H2
Þ Chứng tỏ phản ứng dư Al, oxit sắt phản ứng hết.
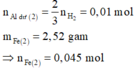
· Phần 1: 14,49 gam Y + HNO3 loãng, dư ® 0,165 mol NO.
Áp dụng bảo toàn electron có:

![]()
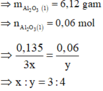
Þ Công thức oxit sắt là Fe3O4.
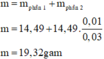

Vì ta có thể tính được ngay số mol của N2 và H2 và đây cũng là dự kiện mấu chốt để tìm m với dạng toàn này nên đầu tiên ta tìm số mol của N2 và H2 bằng cách: đặt nN2 và H2 lần lượt là x, y. Ta được: x + y = 0,025
tỉ khối so với H2: 28x + 2y/ 2(x + y) = 11,4 (với x + y = 0,025)
=> x = 0,02; y = 0,005
Sử dụng bảo toàn electron: số mol electron nhường = số mol electron nhận thì: 2nMg > ***N2 + 2nH2 nên phản ứng có tạo NH4Cl
quá trình oxi hóa: Mg - 2e -----> Mg2+
quá trình khử: 2NO3- -10e ----> N2 (N(+5) -5e ----> N(0))
NO3- -8e ------> NH4+ (n(+5) - 8e ---> N(-3))
2H+ -2e ---> H2
Vậy 2.0,124 = 0,025.10 + 0,005.2 + 8nNH4+ => nNH4+ = 0,01
m = mMgCl2 + mNH4Cl = 0,145.95 + 0,01.53,5 = 14,31 gam
mol Mg = 0,145 ==> mol e nhường = 0,29 ==> mol NH4+ = 0,01
2 NO3- + 10e + 12 H+ ----> N2 + 6 H2O
0,04-------0,2------0,24-------0,02
NO3- + 8e + 10 H+ ----> NH4+ + 3 H2O
0,01----0,08------0,1-------0,01
2 H+ + 2e ----> H2
0,01----0,01------0,005
mol HCl = mol Cl- = mol H+ = 0,35
mol KNO3 = mol K+ = mol NO3- = 0,05
muối gồm : Mg2+ = 0,145 mol, NH4+ = 0,01 mol, K+ = 0,05 và mol Cl- = 0,35
khối lượng muối = 24*0,145 + 39*0,05 + 35,5*0,35 = 18,035

Đáp án B
Nhiệt phân hoàn toàn X ⇒ Y gồm Fe, Al2O3 và Al dư.
Xét phần 2: nAl = nH2 ÷ 1,5 = 0,01 mol; nFe = 0,045 mol
⇒ ne cho TỐI ĐA = 0,01 × 3 + 0,045 × 3 = 0,165 mol.
⇒ phần 1 gấp 0,165 × 3 ÷ 0,165 = 3 lần phần 2.
Xét phần 1: chứa 0,03 mol Al; 0,135 mol Fe.
⇒ nAl2O3 = (14,49 – 0,03 × 27 – 0,135 × 56) ÷ 102 = 0,06 mol.
⇒ nO = 0,18 mol ⇒ x : y = 0,135 ÷ 0,18 = 3 : 4 ⇒ Fe3O4.
m = 4/3 × 14,49 = 19,32(g)

Nhiệt phân hoàn toàn X
⇒ Y gồm Fe, Al2O3 và Al dư.
► Xét phần 2: nAl = nH2 ÷ 1,5 = 0,01 mol;
nFe = 0,045 mol
⇒ ne cho TỐI ĐA = 0,01 × 3 + 0,045 × 3 = 0,165 mol.
⇒ phần 1 gấp 0,165 × 3 ÷ 0,165 = 3 lần phần 2.
► Xét phần 1: chứa 0,03 mol Al; 0,135 mol Fe.
⇒ nAl2O3 = (14,49 – 0,03 × 27 – 0,135 × 56) ÷ 102 = 0,06 mol.
⇒ nO = 0,18 mol ⇒ x : y = 0,135 ÷ 0,18 = 3 : 4 ⇒ Fe3O4.
● m = × 14,49 = 19,32(g)
Đáp án B


- TN1: nH2 = 0,07875 mol => nAl dư = 0,07875.2/3 = 0,0525 mol.
nH2 do pư với HCl = 1,512/ 22,4 = 0,0675 mol => nFe = 0,0675 mol.
- TN2: gọi số mol Al dư là 0,0525x và số mol Fe là 0,0675x (x là tỷ lệ khối lượng giữa phần 1 và phần 2)
=> 0,0525x. 3/2 + 0,0675x = 9,828/22,4 => x = 3
Vậy trong hỗn hợp Y có nAl dư = 0,0525. 4 = 0,21 mol. nFe = 0,0675. 4= 0,27 mol.
pư: 8Al + 3Fe3O4 ---> 4Al2O3 + 9Fe
0,24 <------0,09 <-----------------0,27 mol
=> Hỗn hợp đầu có 0,24+ 0,21 = 0,45 mo, Al và 0,09 mol oxit sắt từ.
=> m = 0,45. 27 + 0,09. 232 = 33,03g