Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nFe = \(\frac{11,2}{56}=0,2mol\)
nAl = \(\frac{m}{27}mol\)
Cốc A : Fe + 2HCl -> FeCl2 + H2
0,2 0,2
Theo định luật bảo toàn khối lượng khối lượng HCl tăng thêm;
11,2 - 0,2.2 = 10,8 g
Cốc B : 2Al + 3H2SO4 -> Al2(SO4)3 + 2H2
\(\frac{m}{27}\) \(\frac{3m}{27.2}\)
Khi cho mg Al vào cốc B thì cốc B tăng thêm là ;
m - \(\frac{3m}{27.2}\).2 = 10,8
=> m = 12,15 g

Câu hỏi của Dịch Thiên Tổng - Hóa học lớp 8 | Học trực tuyến

Cốc A: Fe + 2HCl ---> FeCl2 + H2 (1)
0,2 0,2 mol
Cốc B: 2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2 (2)
m/27 m/18 mol
Số mol Fe = 11,2/56 = 0,2 mol; số mol Al = m/27 mol.
Khối lượng cốc A tăng = khối lượng Fe - khối lượng H2 (bay ra) = 11,2 - 2.0,2 = 10,8 gam.
Khối lượng cốc B tăng = khối lượng Al - khối lượng H2 = m - 2.m/18 = m - m/9 = 8m/9 gam.
Vì cân ở vị trí cân bằng nên khối lượng tăng cốc A = khối lượng tăng ở cốc B. Suy ra: 8m/9 = 10,8 hay m = 12,15 g
Cốc A: Fe + 2HCl ---> FeCl2 + H2 (1)
0,2 0,2 mol
Cốc B: 2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2 (2)
m/27 m/18 mol
Số mol Fe = 11,2/56 = 0,2 mol; số mol Al = m/27 mol.
Khối lượng cốc A tăng = khối lượng Fe - khối lượng H2 (bay ra) = 11,2 - 2.0,2 = 10,8 gam.
Khối lượng cốc B tăng = khối lượng Al - khối lượng H2 = m - 2.m/18 = m - m/9 = 8m/9 gam.
Vì cân ở vị trí cân bằng nên khối lượng tăng cốc A = khối lượng tăng ở cốc B. Suy ra: 8m/9 = 10,8 hay m = 12,15 g

\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 0,2
\(\Rightarrow m_{Fe}+m_{H_2SO_4}=0,2\cdot56+0,2\cdot98=30,8g\)
Cả hai đĩa cân thăng bằng:
\(m_{Fe}+m_{H_2SO_4}=m_{Al}+m_{H_2SO_4}\)
\(\Rightarrow m_{Fe}=m_{Al}=11,2g\)

thiếu đề rồi
nFe =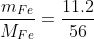
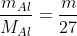
nFe = 0.2 (mol).
nAl =
Xét thí nghiệm 1, ta có phương trình phản ứng:
Fe + 2HCl → FeCl2 + H2
0.2 0.4 0.2 0.2 (Mol)
Dung dịch sau phản ứng có chứa: FeCl2 - 0.2 mol và có thể có axit dư
Xét thí nghiệm 2, ta có phương trình phản ứng:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
m/27 m/54 3m/54 (Mol)
Dung dịch sau phản ứng có chứa: Al2(SO4)3 hoặc có thể có axit còn dư
Vì sau khi phản ứng cái kim đồng hồ cân nặng vẫn ở vị trí cân bằng nên ta có thể suy luận như sau:
Khối lượng kim loại Nhôm khi cho vào cốc A trừ đi khối lượng đã mất đi là khí Hidro ở cốc A phải bằng Khối lượng kim loại Nhôm cho vào cốc B trừ đi lượng khí Hidro thoát ra ở cốc B
Vậy ta có phương trình cân bằng khối lượng của 2 cốc như sau:
Cốc A{mFe - mH2} = Cốc B{mAl - mH2}
11.2 - 0.2*2 = m - 6m/54
48m = 583.2
=>m = 12.15 (g)