Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt nZn = x mol; nFe = y mol.
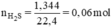
Ta có hệ phương trình: 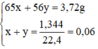
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Theo đề bài ta có bột S dư nên Fe, Zn tác dụng hết với S.
a)Phương trình hóa học của phản ứng.
Zn + S -> ZnS Fe + S -> FeS
x mol x mol y mol y mol
ZnSO4 + H2SO4 -> ZnSO4 + H2S
x mol x mol
FeSO4 + H2SO4 -> FeSO4 + H2S
x mol y mol
Ta có hệ phương trình :
Giải hệ phương trình => x = 0,04 (mol), y = 0,02 (mol).
Vậy mZn = 0,04.65 = 2,6g
mFe = 0,02.56 = 1,12g.

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
Phương trình hóa học của phản ứng:
Zn + S → ZnS
Fe + S → FeS
ZnS + H2SO4 → ZnSO4 + H2S
FeS + H2SO4 → H2S + FeSO4

a)Phương trình:
Zn+S→ZnS; Fe+S→FeS
ZnS+H2SO4→ZnSO4+H2S
FeS+H2SO4→FeSO4+H2S
b)Gọi m, m' là khối lượng Zn, Fe trong hỗn hợp ban đầu
m+m' = 3,72
nH2S=nZnS+nFeS=nZn+nFe=m/65+m'/56
=1,344/22,4=0,06
Bấm máy giải hệ phương trình:
m+m' = 3,72
(1/65).m+(1/56).m' = 0,06
ta được nghiệm: m = 2,6 ; m' = 1,12VV

nFe = 11.2/56 = 0.2 (mol)
Fe + S -to-> FeS
0.2________0.2
FeS + H2SO4 => FeSO4 + H2S
0.2____________________0.2
VH2S = 0.2*22.4 = 4.48 (l)
\(Fe+S\underrightarrow{t^o}FeS\)
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(FeS+H_2SO_4\rightarrow FeSO_4+H_2S\)
\(\Rightarrow V_{H_2S}=0,2.22,4=4,48l\)

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
a) Phương trình hóa học của phản ứng:
Zn + S \(\rightarrow\) ZnS
Fe + S \(\rightarrow\) FeS
ZnS + H2SO4 \(\rightarrow\) ZnSO4 + H2S
FeS + H2SO4 \(\rightarrow\)H2S + FeSO4
nZn = x mol.
nFe = y mol.
nH2S = 1,344 / 22,4 = 0,06 mol.
mhh = 65x + 56y = 3,27g.
nH2S = x + y = 0,06 mol.
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g





Gọi nFe và nMg lần lượt là a và b
\(n_{H2S}=\frac{1,344}{22,4}=0,06\left(mol\right)\)
\(Fe+S\rightarrow FeS\)
a__________a___ mol
\(Mg+S\rightarrow MgS\)
b_________b_____ mol
\(FeS+H_2SO_4\rightarrow FeSO_4+H_2S\)
a_________________________a_mol
\(MgS+H_2SO_4\rightarrow MgSO_4+H_2S\)
b________________________b____ mol
\(\left\{{}\begin{matrix}56a+24b=2,4\\a+b=0,06\end{matrix}\right.\Rightarrow a=b=0,03\left(mol\right)\)
\(m_{Fe}=0,03.56=1,68\left(g\right)\)
\(m_{Mg}=0,03.24=0,72\left(g\right)\)