Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) PTHH:
CuO + H2 =(nhiệt)=> Cu + H2O (1)
Fe2O3 + 3H2 =(nhiệt)=> 2Fe + 3H2O (2)
b) - Dựa vào định nghĩa chất khử và chất oxi hóa
=> Chất khử: H2
Chất Oxi hóa: CuO và Fe2O3
c) Lượng đồng có trong 6g hỗn hợp 2 kim loại thu được:mCu = 6g - 2,8g = 3,2g.
VH2 cần dùng theo phương trình phản ứng(1) = \(\dfrac{3,2}{64}\cdot64=1,12\left(l\right)\) =
VH2 cần dùng theo phương trình phản ứng(2) = \(\dfrac{2,8}{56}\cdot\dfrac{3}{2}\cdot22,4=1,68\left(l\right)\)
a.Phương trình phản ứng:
CuO + H2 Cu + H2O (1)
1mol 1mol 1mol 1mol
Fe2O3 + 3H2 3H2O + 2Fe (2)
1mol 3mol 3mol 2mol
b. + Chất khử là H2 vì chiếm oxi của chất khác;
+ Chất oxi hóa: CuO, Fe2O3 vì nhường oxi cho chất khác.
c. Số mol đồng thu được là: nCu = = 0,5 (mol)
Số mol sắt là: nFe = = 0,05 (mol)
Thể tích khí H2 cần dùng để khử CuO theo phương trình phản ứng (1) là: nH2 = nCu = 0,05 mol => VH2 = 22,4.0,05 = 1,12 (lít)
Khí H2 cần dùng để khử Fe2O3 theo phương trình phản ứng (2) là:
nH2 = nFe =
.0,05 = 0,075 mol
=>VH2(đktc) = 22,4.0,075 = 1,68 (lít)

Đề 15:
1) Theo đề bài , ta có:
NTK(Y)= 2.NTK(Ca)= 2.40=80 (đvC)
=> Nguyên tố Y là brom, KHHH là Br.
2) - Đơn chất là chất do 1nguyên tố tạo thành.
VD: O3; Br2 ; Cl2;......
- Hợp chất là những chất do 2 hay nhiều nguyên tố hóa học trở lên tạo thành.
VD: NaCl, KMnO4, CuSO4, H2O;....
3) Khôi lượng mol? tự trả lời đi !
a) Khối lượng mol của phân tử gồm 2C và 4H
Có nghĩa là khối lượng mol của C2H4
\(M_{C_2H_4}\)= 2.12+4.1=28 (g/mol)
\(M_{H_2S}\)=2.1+32=34(g/mol)

a) Phương trình hóa học của các phản ứng:
H2 + CuO → Cu + H2O (1).
3H2 + Fe2O3 → 2Fe + 3H2O (2).
b) Trong phản ứng (1), (2) chất khử H2 vì chiếm oxi của chất khác, chất oxi hóa là CuO và Fe2O3 vì nhường oxi cho chất khác.
c) Khối lượng đồng thu được từ 6g hỗn hợp 2 kim loại thu được:
mCu = 6g - 2,8g = 3,2g, nCu = 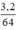 = 0,05 mol
= 0,05 mol
nFe = 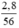 = 0,05 (mol)
= 0,05 (mol)
nH2 (1) = nCu = 0,05 mol ⇒ VH2(1) = 22,4 . 0,05 = 1,12 lít
nH2 (2) = 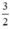 . nFe =
. nFe = 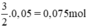 ⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
⇒ VH2 (2) = 22,4 . 0,075 = 1,68 lít khí H2.
VH2 = VH2(1) + VH2(2) = 1,12 + 1,68 = 2,8(l)

Câu 1:
+ Tác dụng với kim loại:
t⁰
2Cu + O2 ------> 2CuO
+ Tác dụng với Hiđro:
t⁰
O2 + 2H2 ------> 2H2O
+ Tác dụng với phi kim:
t⁰
4P + 5O2 ------> 2P2O5
Câu 2:
+ Phản ứng hóa hợp là PƯHH trong đó có một chất mới được tạo thành từ hai hay nhiều chất ban đầu.
t⁰
Fe + O2 ------> Fe3O4
+ Phản ứng phân hủy là PƯHH trong đó có 2 hay nhiều chất được tạo thành từ một chất ban đầu.
t⁰
KClO3 ------> O2 + KCl
Câu 3:
Oxit là hợp chất gồm 2 nguyên tố hóa học trong đó có một nguyên tố là oxy. Công thức hóa học chung: MₓOy
Cách gọi tên cho:
+ Oxit axit: tên phi kim + oxit
P2O5 : điphotpho pentaoxit
+ Oxit bazo: tên kim loại ( kèm theo hóa trị nếu kim loại có nhiều hóa trị ) + oxit
FeO : sắt (II) oxit
Câu 4 :
So sánh:
Giống nhau:
- Đều là sự oxi hoá có toả nhiệt
Khác nhau:
Sự cháy:
- Là phản ứng Oxi hoá xảy ra nhanh.
- Có phát sáng
- Lượng nhiệt toả nhiều
Sự oxi hoá chậm:
- Là phản ứng oxy hoá xảy ra chậm
- Không phát sáng
- Lượng nhiệt toả ít
Điều kiện phát sinh và biện pháp dập tắt sự cháy?
- Điều kiện phát sinh: Cho không khí vào để duy trì sự cháy.
- Biện pháp dập tắt: Ngăn cách ngọn lửa và không khí không cho tiếp xúc với nhau.
Câu 5 : Mk không hiểu mấy kí tự
bài 3
Oxit là hợp chất gồm 2 nguyên tố hóa học trong đó có một nguyên tố là oxy.
Oxit bazơ: là những oxit tác dụng với axit tạo thành muối và nước. Một số Oxit bazơ phản ứng với nước tạo thành bazơ tan gọi là kiềm.
Ví dụ: Na2O - NaOH, Fe2O3 - Fe(OH)3...
Oxit axit: là những oxit tác dụng với bazo tạo ra muối và nước, phản ứng với nước tạo thành 1 axít.
Ví dụ: Mn2O7 - HMnO4, CO2 - H2CO3, P2O5 - H3PO4..
Oxit lưỡng tính: là oxit có thể tác dụng với axit hoặc bazơ tạo muối và nước
Ví dụ: Al2O3, ZnO
Oxit trung tính: là oxit không phản ứng với nước để tạo bazơ hay axit, không phản ứng với bazơ hay axit để tạo muối.
Ví dụ: Cacbon monoxit - CO, Nitơ monoxit - NO,...
bài 4
- lqphuc2006
Đáp án:
So sánh:
Giống nhau:
- Đều là sự oxi hoá có toả nhiệt
Khác nhau:
Sự cháy:
- Là phản ứng Oxi hoá xảy ra nhanh.
- Có phát sáng
- Lượng nhiệt toả nhiều
Sự oxi hoá chậm:
- Là phản ứng oxy hoá xảy ra chậm
- Không phát sáng
- Lượng nhiệt toả ít
Giải thích:
Sự cháy trong không khí xảy ra chậm hơn và tạo ra nhiệt độ thấp hơn sự cháy trong oxi bởi vì không khí là một hỗn hợp khí trong đó oxi chiếm 1/5 còn lại là nhiều chất khí khác; do đó trong không khí khi cháy lượng oxi có thể cung cấp không đủ cho sự cháy hoặc cung cấp không liên tục. Mặt khác, nhiệt lượng cháy còn bị tiêu hao do làm nóng các khí khác (như nitơ, cacbonic,…). Vì vậy nhiệt lượng tỏa ra cũng thấp hơn so với khi cháy trong oxi nguyên chất.
Điều kiện phát sinh và biện pháp dập tắt sự cháy?
- Điều kiện phát sinh: Cho không khí vào để duy trì sự cháy.
- Biện pháp dập tắt: Ngăn cách ngọn lửa và không khí không cho tiếp xúc với nhau.

Câu 1.
1. 4P + 5O2 → 2P2O5
2. 4H2 + Fe3O4 \(\underrightarrow{t^o}\) 3Fe + 4H2O
3. 3Ca + 2H3PO4 → Ca3(PO4)2 + 3H2
4. CaCO3 + 2HCl → CaCl2 + CO2 + H2O
5. Zn + 2HCl → ZnCl2 + H2\(\uparrow\)
6. Fe + CuSO4 → FeSO4 + Cu
7. CO2 + Ca(OH)2 → CaCO3 + H2O
các câu còn lại đọc lại sách hoặc là nghe những bài giảng trên mạng là sẽ làm đc, chứ tớ ngán làm quá



Gọi số mol của O2 là x
Ta có PTHH to
4 FeSO4 ➞ 2 Fe2O3 (r) + 4 SO2 (k) + O2 (k)
Mol 4x 2x 4x x
Khối lượng khí sinh ra trong PƯHH: 76 - 47,2 = 28,8 (g)
Từ PTHH, ta lập ra được 1 pt :
mSO2 + mO2 = 28,8
⇒ 4x.( 32 + 16.2) + 32x = 28,8
⇒ 256x + 32x = 28,8 ⇒ 288x = 28,8 ⇒ x = 0,1 ( mol )
Do đó số mol của FeSO4 PỨ là : nFeSO4= 0,1.4=0,4 ( mol )
⇒ mFeSO4 phản ứng = 0,4 . 152 = 60,8 ( g )
Hiệu suất Phản ứng là : \(\frac{60,8}{76}.100=80\left(\%\right)\)