Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

CTHH của X : $R_2O$
Ta có : $\%R = \dfrac{2R}{2R + 16}.100\% = 74,194\% \Rightarrow R = 23(Natri)$
$Na_2O + H_2O \to 2NaOH$
$m_{dd\ Y} = 15,5 + 184,5 = 200(gam)$
$n_{NaOH} = 2n_{Na_2O} = 2.\dfrac{15,5}{62} = 0,5(mol)$
$C\%_{NaOH} = \dfrac{0,5.40}{200}.100\% = 10\%$
Chọn đáp án B

a)
R thuộc họ p và có 5 electron ở lớp ngoài cùng => R thuộc nhóm VA , trong hợp chất oxit cao nhất với oxi R có hóa trị V
=> CT : R2O5
b)
%R = \(\dfrac{2R}{2R+16.5}\).100% = 43,66% => R = 31(g/mol)
=> R là photpho (P)

Chọn B
R có 4 electron lớp ngoài cùng, e cuối cùng điền vào phân lớp np → R thuộc nhóm IVA
→ Hợp chất khí với hiđro và oxit cao nhất của R lần lượt là R O 2 , R H 4 .
Ta có:
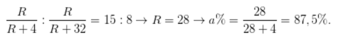

1. \(n_{HCl}=\dfrac{14,6.100}{100.36,5}=0.4\left(mol\right)\)
Gọi kí hiệu hóa học của kim loại nhóm IA cần tìm là M.
PTHH: \(M+H_2O\rightarrow MOH+\dfrac{1}{2}H_2\uparrow\) (1)
Mol: 0,4_________0,4
\(MOH+HCl\rightarrow MCl+H_2O\) (2)
Mol: 0,4______0,4
Theo (1) và (2) ta có: \(n_M=n_{MOH}=n_{HCl}=0,4\left(mol\right)\)
Mặt khác \(m_M=9,2\left(g\right)\Rightarrow M_M=\dfrac{9,2}{0,4}=23\left(Natri\right)\)
Vậy kim loại cần tìm là Na.
2. Vì M thuộc nhóm IIA nên M có hóa trị II. \(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: \(MCO_3+2HCl\rightarrow MCl_2+H_2O+CO_2\uparrow\left(1\right)\)
Mol: 0,15 __________________________ 0,15
Theo (1) ta có \(n_{MCO_3}=n_{CO_2}=0,15\left(mol\right)\)
\(\Rightarrow M_{MCO_3}=\dfrac{12,6}{0,15}=84\left(đvC\right)\) hay: \(M_M+60=84\Leftrightarrow M_M=24\left(Magie\right)\)
PTHH: \(MgCO_3+2HCl\rightarrow MgCl_2+H_2O+CO_2\uparrow\)
mol: 0,15______________________________0,15
Theo phương trình, \(n_{HCl}=0,15.2=0,3\left(mol\right)\)\(\Rightarrow m_{HCl}=0,3.36,5=10,95\left(g\right)\Rightarrow m_{ddHCl}=\dfrac{10,95.100}{14,6}=75\left(g\right)\)\(\Rightarrow m_{ddX}=12,6+75-0,15.44=81\left(g\right)\)
\(m_{MgCl_2}=0,15.95=14,25\left(g\right)\Rightarrow C\%_{MgCl_2}=\dfrac{14,25}{81}.100\%\approx17,5926\%\)
3. R thuộc nhóm VA (vì sao thì bạn tự biết)
\(\Rightarrow\) Hợp chất khí của R với H sẽ có dạng : \(RH_3\)
Theo đề: \(\dfrac{R}{3+R}=8,82\%\Rightarrow R\approx31\left(Photpho\right)\)
4.Theo phân tích đề ta có: hóa trị cao nhất trong oxit của R là VI.
\(\Rightarrow\) Công thức oxit của R có dạng: \(RO_3\)
Mặt khác: \(\dfrac{3.16}{R+3.16}=60\%\Rightarrow R=32\)
Vậy R là lưu huỳnh (S)
CHÚC BẠN HỌC TỐT!!!!!!!

Vì hợp chất với hidro có dạng RH => X hoặc Y thuộc nhóm IA hoặc VIIA
*TH1: Y thuộc nhóm IA => CT hidroxit : YOH
theo đề ta có: Y/(Y+17)=0.35323
=>Y=9.28 (loại)
*TH2: Y thuộc nhóm VIIA=> CT hidroxit: HYO4
theo đề ta có: Y/(1+Y+16.4)=0.35323
=> Y=35.5 Cl
theo đề ta thấy: trung hòa A cần dùng dung dịch B. Mà B là axit => A là bazo
=> X thuộc nhóm IA => CTHH: XOH
PT: XOH + HClO4 -> XClO4 +H2O
0.15 0.15 (MOL)
m(XOH)=(50.16,8)/100=8,4=>M(XOH)=m/n=56=>X=39 (Kali)
Hợp chất với hiđro có dạng RH nên Y có thể thuộc nhóm IA hoặc VIIA.
Trường hợp 1 : Nếu Y thuộc nhóm IA thì B có dạng YOH
Ta có : \(\frac{Y}{17}=\frac{35,323}{64,677}\Rightarrow\)\(Y=9,284\) (loại do không có nghiệm thích hợp)
Trường hợp 2 : Y thuộc nhóm VIIA thì B có dạng HYO4
Ta có : \(\frac{Y}{65}=\frac{35,323}{64,377}\Rightarrow Y=35,5\), vậy Y là nguyên tố clo (Cl).
B (HClO4) là một axit, nên A là một bazơ dạng XOH
\(m_A=\frac{16,8}{100}.50g=8,4g\)
XOH + HClO4 \(\rightarrow\) XClO4 + H2O
\(\Rightarrow n_A=n_{HClO_4}=0,15L.0,1\text{/}L=0,15mol\)
\(\Rightarrow M_X+17g\text{/}mol=\frac{0,84g}{0,15mol}\)
\(\Rightarrow\) MX = 39 gam/mol, vậy X là nguyên tố kali (K).