Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) CT hợp chất khí cao nhất : RH3
=> CT hợp chất với O : R2O5
%R = 2R/(2R + 16*5) *100% = 43.66%
<=> R = 31
=> R : P
b)
R thuộc nhóm VII A => R có hóa trị cao nhất với O là VII
=> CT hợp chất khí với H : RH
%H = 1/(R+1) *100% = 39/50%
=> R = 127
=> R là : I
c) R thuộc nhóm VII A => R có hóa trị cao nhất với O là: VII
=> CT : R2O7
%R = 2R/(2R + 16*7) *100% = 38.79%
=> R = 35.5
=> R là : Cl
d) Oxit cao nhất là : R2O5
=> CT hợp chất khí với H : RH3
%H = 3/(R+3) *100% = 17.65%
=> R = 14
=> R là : N
a)
công thức hợp chất của R với H là RH3 => công thức oxit cao nhất của R là R2O5
ta có : 2R / 2R + 16.5 = 43,66%
=> R= 31 => photpho
c) CTHH:R2O7
R chiếm 38.79%
Suy ra
\(\frac{2R}{2R+16.7}=\)0,3879
=>2R=0,,7758R+42,44
=>1,22R=43,44
=>R=36 Xem lại đề
d)
R2O5
công thức với hidro là : RH3
Ta có : R/R+3=0,9118⇒R=31 là P
f) R+2HCl--->RCl2+H2
n\(_{H2}=\frac{4,48}{22,4}=0,2\left(mol\right)\)
Theo pthh
n\(_R=n_{H2}=0,2\left(mol\right)\)
M\(_M=\frac{13}{0,2}=65\left(Zn\right)\)

Bài 1
Gọi mol X là x, mol Y là Y
n\(_{H2}=\frac{5,6}{22,4}=0,25\left(mol\right)\)
2X+2xH2O--->2X(OH)x+xH2
n\(_{OH}=2n_{H2}=0,5\left(mol\right)\)=> \(x+2y=0,5\rightarrow\frac{x}{2}+y=0,25\)
=> M\(_{tb}=\frac{7,1}{x+y}\rightarrow\frac{7,1}{x+2y}< M_{tb}< \frac{7,1}{\frac{x}{2}+y}\)
=> 14,2<Mtb<28
=> X có thể là Na,Y có thể là Mg
Bài 3
oxit cao nhất của chu kỳ 2 là N2O5
Oxxit cao nhất của chu kỳ 3 là R2O5
Bài 4
CTHH: RO3
Theo bài ta có
\(\frac{48}{R+48}.100\%=60\)
=>\(\frac{48}{R+48}=0,6\rightarrow48=0,6R+28,8\)
=> \(0,6R=19,2\rightarrow R=32\)lưu huỳnh
=>CTHH:SO3
Bài 5
CTHH: Y2O3
Theo bài ta có
\(\frac{2Y}{2Y+48}=38,8\rightarrow\frac{2Y}{2Y+112}=0388\)
= \(2Y=0,776Y+18,624\)
=>\(1,224Y=18,624\)
=>Y=14(Ni tơ)
CTHH:N2O3
Bài 6
CTHH:RO
Theo bài
\(\frac{R}{R+16}.100\%=10,46\rightarrow\frac{R}{R+16}=0,1046\)
=> R=0,1046R+1,67
=>0,8954R=1,67
Xem lại đề
Câu 1:
Giả sử chỉ KL kiềm tác dụng vs HCl
\(n_{KL}=\text{2. nH2=0,5}\Rightarrow PTK_{tb}=\text{m hh/ 0,5=14,2}\)
Giả sử chỉ cs KL kiềm thổ ác dụng
n Kiềm thổ =n H2 =0,25 ---> PTK trung bình< mhh/0,25=28,4
2KL đó là Na và Mg
Câu 2
\(\text{GỌi Ct chung của 2 KL đó là A}\)
PTK trung bình của A = 18/0,5=36----> 2 Kl đó là Mg và Ca

1.
Đặt công thức oxit là A2On (với n = 1, 2, …, 7)
%mA =\(\frac{2A}{2A+16n}\).100% = 52,94%
→ 0,9412A = 8,4704n
→ A = 9n
Bài 2:
Công thức oxit cao nhất là R2On → %mR = \(\frac{2R}{2R+16n}\text{.100%}\)
Công thức hợp chất khí với H là RH8-n → %mR =\(\frac{R}{R+8-n}.100\%\)
Theo đề bài tỉ lệ thành phần phần trăm của R trong oxit cao nhất và trong hợp chất khí với H là 0,5955 nên suy ra:\(\frac{\frac{2R}{2R+16n}}{\frac{R}{R+8-n}}=0,5955\)
\(\rightarrow\frac{2R\left(R+8-n\right)}{R\left(2R+16n\right)}=0,5955\)
\(\rightarrow\frac{2\left(R+8-n\right)}{\left(2R+16n\right)}=0,5955\)
\(\rightarrow0,809R=11,528n-16\rightarrow R=\frac{11,528n-16}{0,809}\)
Do R là phi kim nên n = 5, 6, 7 thay vào thấy với n = 7; R = 80 thỏa mãn
Vậy R là Brom (Br)
Bài 3 :
Đặt công thức 2 oxit trên là RxOy và RaOb
Ta có
\(\frac{Rx}{16y}=\frac{7}{12}\)\(\rightarrow\)Rx=\(\frac{28y}{3}\)⇒R=\(\frac{28y}{3x}\)=\(\frac{14}{3}.\frac{2y}{x}\) (với 2y/x là hóa trị của R)
Lập bảng biện luận hóa trị\(\rightarrow\) Với \(\frac{2y}{3}\)=3>R=14(R là Nito)
\(\frac{2y}{x}\)=3thì 2y=3x\(\rightarrow\frac{x}{y}=\frac{2}{3}\)
Do đó CTHH RxOy là N2O3
RaOb \(\Leftrightarrow\)NaOb
R chiếm \(\frac{y}{11}\) mới đúng nhé
Ta có \(\frac{14a}{16b}\)=\(\frac{7}{4}\)\(\rightarrow\)56a=112b\(\rightarrow\frac{a}{b}=\frac{2}{1}\)
Do đó CTHH NaOb là N2O
Bài 4 :
2X+2H2O\(\rightarrow\)2XOH+H2
nH2=\(\frac{3,36}{22,4}\)=0,15(mol)
\(\rightarrow\)MX=\(\frac{8,5}{0,3}\)=28,333
\(\rightarrow\) 2 kim loại là Na và K

2. cthc oxit cao nhất của RH3 là R2O5
%R = 100 - 74,07 = 25,93%
\(\dfrac{2M_R}{25,93}=\dfrac{80}{74,07}\)
\(\Rightarrow M_R=14\)
R là Nitơ ( N )
\(Bài1.\)
Gọi hai kim loại đó là A, n là hóa trị trung bình
\(2A+2nHCl\rightarrow2ACl_n+nH_2\)
\(n_{H_2}\left(đkct\right)=0,03\left(mol\right)\)
Theo PTHH: \(n_{HCl}=2n_{H_2}=0,06\left(mol\right)\)
\(\Rightarrow m_{HCl}\left(pứ\right)=0,06.36,5=2,19\left(g\right)\)
Ap dung ĐLBTKL: \(\Rightarrow a=2+2,19-0,03.2=4,13\left(g\right)\)
\(Bài 2.\)
Vì R tạo với Hỉdro hợp chất là RH3
\(\Rightarrow\) R tạo với Oxi hợp chất là \(R_2O_5\)
Theo đề, ta có: \(74,07=\dfrac{16.5.100}{2R+16.5}\)
\(\Rightarrow R< 0\)
Không có kim loại nào thõa đề bài trên
Bạn xem lại đề xem, số liệu ....
\(Bài 3.\)
Gọi R là kim loai có hóa trị I cần tìm:
\(2R+2HCl\rightarrow2RCl+H_2\)
\(n_R=\dfrac{4,6}{R}\left(mol\right)\)
\(n_{H_2}=\dfrac{1,321}{22,4}\left(mol\right)\)
Theo PTHH: \(n_R=2n_{H_2}\)
\(\Leftrightarrow\dfrac{4,6}{R}=\dfrac{2,642}{22,4}\)
\(\Leftrightarrow R=39\left(K\right)\)
Vậy kim loại đó là Kali

1. \(n_{HCl}=\dfrac{14,6.100}{100.36,5}=0.4\left(mol\right)\)
Gọi kí hiệu hóa học của kim loại nhóm IA cần tìm là M.
PTHH: \(M+H_2O\rightarrow MOH+\dfrac{1}{2}H_2\uparrow\) (1)
Mol: 0,4_________0,4
\(MOH+HCl\rightarrow MCl+H_2O\) (2)
Mol: 0,4______0,4
Theo (1) và (2) ta có: \(n_M=n_{MOH}=n_{HCl}=0,4\left(mol\right)\)
Mặt khác \(m_M=9,2\left(g\right)\Rightarrow M_M=\dfrac{9,2}{0,4}=23\left(Natri\right)\)
Vậy kim loại cần tìm là Na.
2. Vì M thuộc nhóm IIA nên M có hóa trị II. \(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: \(MCO_3+2HCl\rightarrow MCl_2+H_2O+CO_2\uparrow\left(1\right)\)
Mol: 0,15 __________________________ 0,15
Theo (1) ta có \(n_{MCO_3}=n_{CO_2}=0,15\left(mol\right)\)
\(\Rightarrow M_{MCO_3}=\dfrac{12,6}{0,15}=84\left(đvC\right)\) hay: \(M_M+60=84\Leftrightarrow M_M=24\left(Magie\right)\)
PTHH: \(MgCO_3+2HCl\rightarrow MgCl_2+H_2O+CO_2\uparrow\)
mol: 0,15______________________________0,15
Theo phương trình, \(n_{HCl}=0,15.2=0,3\left(mol\right)\)\(\Rightarrow m_{HCl}=0,3.36,5=10,95\left(g\right)\Rightarrow m_{ddHCl}=\dfrac{10,95.100}{14,6}=75\left(g\right)\)\(\Rightarrow m_{ddX}=12,6+75-0,15.44=81\left(g\right)\)
\(m_{MgCl_2}=0,15.95=14,25\left(g\right)\Rightarrow C\%_{MgCl_2}=\dfrac{14,25}{81}.100\%\approx17,5926\%\)
3. R thuộc nhóm VA (vì sao thì bạn tự biết)
\(\Rightarrow\) Hợp chất khí của R với H sẽ có dạng : \(RH_3\)
Theo đề: \(\dfrac{R}{3+R}=8,82\%\Rightarrow R\approx31\left(Photpho\right)\)
4.Theo phân tích đề ta có: hóa trị cao nhất trong oxit của R là VI.
\(\Rightarrow\) Công thức oxit của R có dạng: \(RO_3\)
Mặt khác: \(\dfrac{3.16}{R+3.16}=60\%\Rightarrow R=32\)
Vậy R là lưu huỳnh (S)
CHÚC BẠN HỌC TỐT!!!!!!!

a. PTHH: R + H2SO4 ---> RSO4 + H2 (1)
Ta có: \(n_{H_2}=\dfrac{3,584}{22,4}=0,16\left(mol\right)\)
Theo PT(1): \(n_R=n_{H_2}=0,16\left(mol\right)\)
=> \(M_R=\dfrac{3,84}{0,16}=24\left(g\right)\)
Vậy R là magie (Mg)
b. PTHH:
Mg + HCl ---> MgCl2 + H2 (2)
Theo PT(2): \(n_{H_2}=n_{Mg}=0,16\left(mol\right)\)
=> \(V_{H_2}=0,16.22,4=3,584\left(lít\right)\)
(Do câu b đề ko rõ lắm nên mik làm như vậy, nếu sai bn bình luận nhé.)

Câu 1 : \(\%_H=\frac{3}{R+3}\cdot100=17.65\)
\(\Rightarrow R=14\)
Vậy R là N(Nitơ)
Câu 2:
Nguyên tố X có hóa trị cao nhất với Oxi gấp 3 lần so vs hc của Hidro nên X thuộc nhóm VIA
hóa trị cao nhất vs Oxi là XO3
mà tỉ khối hơi so với Nitơ là 2.875 tức MXO3 =80.5
MX=32.5
Vậy X là S(Lưu huỳnh)
1.
\(\text{% R= 100-% H= 100-17,65 = 82.35 %}\)
Ta có :
\(\frac{MR}{\%R}=\frac{MH}{\%H}\Rightarrow\frac{MR}{82,35}=\frac{3}{17,65}\)
\(\Rightarrow MR=13,99\approx14\left(đvC\right)\)
\(\rightarrow\)R là nitơ (NH3)
2.
Hóa trị của X vs oxi, hidro lần lượt là x,y
\(\Rightarrow\left\{{}\begin{matrix}\text{x + y = 8}\\\text{x =3y}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}\text{x = 6}\\\text{y = 2}\end{matrix}\right.\)
Hợp chất của X vs oxi là XO3
\(\rightarrow\text{M(XO3) = 2,857.28=80}\)
\(\rightarrow\text{X = 32 }\)
\(\rightarrow\)Lưu huỳnh(S)
3.
Hợp chất của R vs Oxi là R2O5
\(\%R=\frac{2R}{\left(2R+16.5\right)}\text{= 0,4366}\)
\(\rightarrow R=31\left(\frac{g}{mol}\right)\)
\(\rightarrow\) R là Photpho
4.
Y tạo vs Oxi hợp chất YO3
\(\rightarrow\) Y tạo vs H hợp chất H2Y
Và Y ở chu kì 3\(\rightarrow\) Y là S
\(\%M=\frac{M}{\left(M+2.32\right)}\text{ = 0,4667}\)
\(\rightarrow\text{M = 56}\)
\(\Rightarrow\)M là Sắt(Fe)
Lần sau bn đăng tách câu hỏi ra cho dễ nhìn nhé
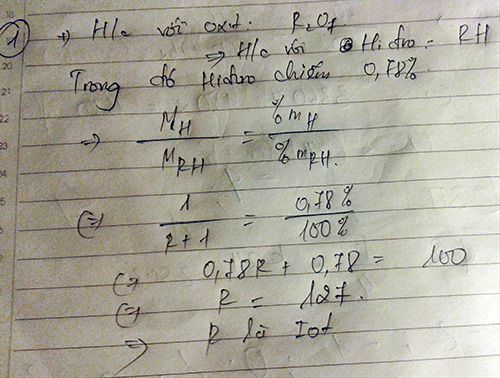
a)
Nguyên tố R có cấu hình e lớp ngoài cùng là ns1
=> Công thức oxit cao nhất của R là R2O
\(\dfrac{2.M_R}{2.M_R+16}.100\%=74,19\%=>M_R=23\left(Na\right)\)
b)
TH1:
\(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
PTHH: 2Na + 2H2O --> 2NaOH + H2
______0,2----------------------->0,1
=> VH2 = 0,1.22,4 = 2,24 (l)
TH2:
\(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
PTHH: 2Na + 2HCl --> 2NaCl + H2
_____0,2------------------------->0,1
=> VH2 = 0,1.22,4 = 2,24 (l)
c)
K --> K+ + 1e
O + 2e --> O2-
2 ion K+ và O2- trái dấu nên hút nhau bởi lực hút tĩnh điện
2K+ + O2- --> K2O