Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

C2H2 + 2AgNO3 + 2NH3 → C2Ag2 ↓ + 2NH4NO3
CH3CHO + 2AgNO3 + 3NH3 + H2O → CH3COONH4 + 2Ag ↓ + 2NH4NO3
C2Ag2 + 2HCl → 2AgCl ↓ + C2H2 ↑
Y(AgCl, Ag) + HNO3 --> ...
Ag + 2HNO3 → AgNO3 + NO2 ↑ + H2O

\(2CH_3COOH+2Na\rightarrow2CH_3COONa+H_2\uparrow\)
\(m_{CH_3COOH}=60\left(g\right)\)
\(n_{CH_3COOH}=1\left(mol\right)\)
\(\Rightarrow n_{H_2}=0,5\left(mol\right)\Rightarrow m_{H_2}=1\left(g\right)\)
2CH\(_3\)COOH+2Na\(\Leftrightarrow\)2CH\(_3\)COONa+H\(_2\uparrow\)
MCH\(_3\)COOH=60(G)
NCH\(_3\)COOH=1(MOL)
\(\Leftrightarrow\)NH\(_2\)=0,5(MOL)\(\Leftrightarrow\)MH\(_2\)=1(G)


chộ cái mặt nhà mi là biết rồi , vào trang chủ của tau rồi bấm theo dõi đi

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 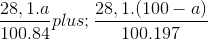 = 0,2
= 0,2
=> a = 29,89.

a) Zn + S ---> ZnS; Fe + S ---> FeS;
ZnS + H2SO4 ---> ZnSO4 + H2S; FeS + H2SO4 ---> FeSO4 + H2S
b) Gọi x, y là số mol Zn và Fe: 65x + 56y = 3,72 và x + y = 1,344/22,4 = 0,06
Giải hệ: x = 0,04; y = 0,02 ---> mZn = 65.0,04 = 2,6 g; mFe = 56.0,02 = 1,12 g.
a)Phương trình:
Zn+S→ZnS; Fe+S→FeS
ZnS+H2SO4→ZnSO4+H2S
FeS+H2SO4→FeSO4+H2S
b)Gọi m, m' là khối lượng Zn, Fe trong hỗn hợp ban đầu
m+m' = 3,72
nH2S=nZnS+nFeS=nZn+nFe=m/65+m'/56
=1,344/22,4=0,06
Bấm máy giải hệ phương trình:
m+m' = 3,72
(1/65).m+(1/56).m' = 0,06
ta được nghiệm: m = 2,6 ; m' = 1,12

Fe được hòa tan hoàn toàn bởi dd HNO3 thu được dd X, khi thêm HCl vào X có khí NO thoát ra → trong X có ion Fe2+ → HNO3 đã phản ứng hết
n(NO) = 1,12/22,4 = 0,05mol
Fe + 4HNO3 → Fe(NO3)3 + NO + 4H2O
0,05___0,2______________0,05
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
x___________________3x
Theo ĐL bảo toàn nguyên tố, số mol NO3- có trong muối:
n(NO3- trong muối) = n(HNO3) - n(NO) = 0,15mol
n(NaOH) = 0,115.2 = 0,23mol
Sau khi NaOH pư hoàn toàn với các chất trong dd Y, dung dịch thu được có:
n(Na+) = n(NaOH) = 0,23mol; n(Cl-) = n(HCl) = 0,1mol
→ n(NO3-) = n(Na+) - n(Cl-) = 0,23 - 0,1 = 0,13mol
→ Số mol NO3- bị Fe2+ khử: 0,15 - 0,13 = 0,02mol
NO3- + 3Fe2+ + 4H+ → 3Fe3+ + NO + 2H2O
0,02___0,06____0,08
NO3- và H+ đều dư (H+ dư 0,02mol) → Fe2+ đã phản ứng hết → 3x = 0,06 → x = 0,02mol
Tổng số mol Fe: n(Fe) = 0,05 + x = 0,07mol
Khối lượng Fe đã sử dụng: m(Fe) = 0,07.56 = 3,92g

b)
= 10 (gam)
=> phản ứng =
= 0,01 (mol)
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
0,005 0,01 0,01 (mol)
Khối lượng của vật sau phản ứng là:
10 + 108.0,01 - 64.0,005 = 10,76 (gam)
Đáp án D
Ban đầu khi ngâm lá Zn trong ống nghiệm đựng HCl xảy ra quá trình ăn mòn hóa học:
Zn + 2HCl → ZnCl2 + H2 ↑
Khi thêm vài giọt dung dịch CuSO4 vào ống nghiệm thì:
Zn + CuSO4 → ZnSO4 + Cu ↓
Khi đó xảy ra ăn mòn điện hóa, Zn đóng vai trò là cực âm, Cu đóng vai trò là cực dương:
Zn (-): Zn → Zn2+ + 2e
Cu (+): 2H+ + 2e → H2 ↑
Ở cực âm xảy ra quá trình ăn mòn Zn (oxi hóa Zn), H+ khi đó di chuyển đến cực dương để nhận e và xảy ra sự khử ion H+ tạo khí H2 Mặt khác, quá trình ăn mòn điện hóa nhanh hơn so với ăn mòn hóa học nên tốc độ thoát khí sẽ tăng.