Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử có 100 gam quặng sắt, khối lượng Fe2O3 là 80 gam và khối lượng SiO2 là 10 gam
Số mol Fe2O3 là nFe2O3 = 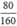 = 0,5(mol)
= 0,5(mol)
nFe = 2 x nFe2O3 = 0,5.2 = 1(mol)
→ mFe = 1.56 = 56(g)
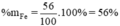
Tương tự tính cho Si , %Si = 4,7%
Đáp án là A.

Khối lượng sắt có trong tấn gang chứa 95% sắt là : (tấn).
Khối lượng sắt thực tế cần phải có là : (tấn).
Fe3O4 -> 3Fe
232 tấn 3.56= 168 tấn
Muốn có 767,68 tấn sắt, cần : (tấn)Fe3O4
Khối lượng quặng manhetit cần dùng là : (tấn).

Bạn bấn vào đây, có người hỏi bài này rồi nhá Câu hỏi của Mạc Nhược Ca - Hóa học lớp 12 | Học trực tuyến

Áp dụng định luật bảo toàn khối lượng ta có :
m_{hh} + m_{CO} = m_{Fe}+m_{CO_{2}}mhh+mCO=mFe+mCO2.
=> mFe = 17,6 +0,1 . 1,28 - 0,1.44 = 16 (gam).
Đáp án B.
Áp dụng định luật bảo toàn khối lượng ta có :
.
=> mFe = 17,6 +0,1 . 1,28 - 0,1.44 = 16 (gam).

Goi x la so gam cua CuO
x+15,2 la so gam cua Fe3O4
Ta co x+(x+15,2)=31,2 =>x=8
mCuO=8g=>n=0,1mol
mFe3O4=23,2g=>n=0,1 mol
CuO + H2-->Cu+ H2O
0,1 0,1
Fe3O4+4H2O--->Fe+H2O
0,1 0,1
mCu=0,1.64=6,4g
mFe=0,1.56=5,6g

Chọn A.
Zn + 2H+ → Zn2+ + H2
Fe + 2H+ → Fe2+ + H2
= 0,04 (mol)
Gọi x và y là số mol của Zn và Fe
Ta có hệ phương trình:
=> x = 0,01; y = 0,03
%mZn = .100% = 27,9%; %mFe = 72,1%
Ngân 2,33 gam hợp kim Fe-Zn trong lượng dư dung dịch HCl đến khi phản ứng xẩy ra hoàn toàn thấy giải phóng 896 ml khí H2 (đktc). Thành phần phần trăm về khối lượng của hợp kim này là
A. 27,9% Zn và 72,1% Fe
B. 26,9% Zn và 73,1% Fe
C. 25,9% Zn và 74,1% Fe
D. 24,9% Zn và 75,1% Fe

nO2=7.36-5.6 /32 = 0.055.
dB/H2= 19 --> nNO=nNO2=a(mol)
BT e : 3nFe= 4nO2 + 3nNO + nNO2
<=> 0.3= 0.22 + 4a
=> a= 0.04 --> V= 0.896 l
Giả sử có 100 gam quặng sắt thì khối lượng Fe2O3 là 80 gam và khối lượng SiO2 là 10 gam
=> \(n_{Fe}=2n_{Fe_2O_3}=2.\dfrac{80}{160}=1\left(mol\right)\\ n_{Si}=n_{SiO_2}=\dfrac{10}{60}=\dfrac{1}{6}\left(mol\right)\)
Ta có :
\(\%Fe=\dfrac{m_{Fe}}{m_{quặng}}.100=\dfrac{1.56}{100}=56\%\\ \%Si=\dfrac{m_{Si}}{m_{quặng}}=\dfrac{\dfrac{1}{6}.28}{100}=4,7\%\)
=> Chọn A
A.