Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

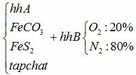
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
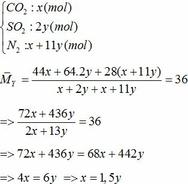
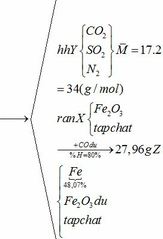
Khối lượng Fe có trong Z là:
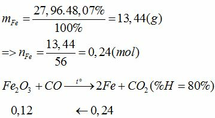
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
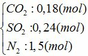
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
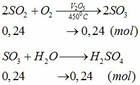
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
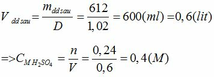

\(\overline{M}=24\cdot2=48\)
\(\dfrac{n_{SO_2}}{n_{O_2}}=\dfrac{64-48}{48-32}=1\)
\(n_{hh}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(\Rightarrow n_{SO_2}=n_{O_2}=0.15\left(mol\right)\)
\(2SO_2+O_2\underrightarrow{^{t^0,V_2O_5}}2SO_3\)
Bđ:0.15....0.15
Pư: x..........0.5x......x
KT: 0.15-x..0.15-0.5x..x
\(n_{hh}=0.15-x+0.15-0.5x+x=0.3-0.5x\left(mol\right)\)
\(m=\left(0.15-x\right)\cdot64+\left(0.15-0.5x\right)\cdot32+80x=\left(0.3-0.5x\right)\cdot2\cdot26\)
\(\Rightarrow x=\dfrac{3}{65}\)
\(H\%=\dfrac{\dfrac{3}{65}}{0.15}\cdot100\%=30.7\%\)


Do lấy dư 20% oxi so với lượng cần đốt cháy nên lượng oxi đã lấy là:


Tổng khối lượng CO2 và SO2 :
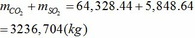
Chú ý:
Lượng O2 lấy dư 20% so với với lượng cần thiết => tính mol O2 chính xác

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

nCuO=160/80=2 mol
CuO + H2SO4 =>CuSO4 + H2O
2 mol => 2 mol
mCuSO4(A)=2.160=320g
Mà mdd A=800g=>mH2O(A)=480g
Gọi nCuSO4.5H2O tách ra=a mol
mCuSO4 kết tinh=160a gam
mH2O kết tinh=90a gam
=>mCuSO4 trg dd sau=320-160a gam
mH2O trg dd sau=480-90a gam
Ở 0°C S=14,3g
Cứ 100g H2O hòa tan đc 14,3g CuSO4 tạo dd bão hòa
Mà (480-90a) gam H2O hòa tan đc (320-160a) gam CuSO4
=>14,3(480-90a)=100(320-160a)
=>a=1,7084 mol
=>m tinh thể tách ra=1,7084.250=427,105gam

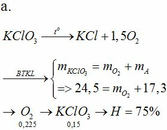
b.
4P + 5O2 → 2P2O5
0,16→ 0,2
Dư: 0,025
Sau pứ m(bình 1) = mP2O5 = 11,36 (g)
O2 + 2C → 2CO
0,025→ 0,05 0,05
Dư: 0,25
Sau pứ m(bình 2) = mCdư = 3 (g)

/ nồng độ dung dịch KAl(SO4)2 bão hòa ở 20 độ C là 5,66%=> 600g dd KAl(SO4)2 chứa 600*5,66%=33,96g KAl(SO4)2 và 600-33,96g=566,04g H2O
độ tan = (33,96*100)/566,04=5,9996
b/ mH2O còn lại = 566,04-200=366,04g
nKAl(SO4)2=33,96/258 (mol)
nH2O=336,04/18(mol)
KAl(SO4)2 + 12H2O --->KAl(SO4)2.12H2O
33,96/258--------336,04/18
=> H2O dư
=>nKAl(SO4)2.12H2O=nKAl(SO4)2=33,96/25...
=>mKAl(SO4)2.12H2O=33,96/258*474=62,39...

nhầm môn rồi