
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


12.
Na2CO3+H2SO4->Na2SO4+H2O+CO2
............. 0,5 ............. ......... 0,5
CO2+2KOH->K2CO3+H2O
x 2x x
CO2+KOH->KHCO3
y y y
mKOH=98.40/100=39,2g
nKOH=39,2/56=0,7mol
Có:
2x+y=0,7
138x+100y=57,6
=>x=0,2mol; y=0,3mol
mK2CO3=138.0,2=27,6g
mKHCO3=57,6-27,6=30g
b.
nCO2=x+y=0,2+0,3=0,5mol
CMddH2SO4=0,5/0,2=2,5M
8. Hoàn thành sơ đồ chuyển hóa sau:
Mg \(\underrightarrow{\left(1\right)}\) MgO \(\underrightarrow{\left(2\right)}\) MgCl2 \(\underrightarrow{\left(3\right)}\) Mg(OH)2 \(\underrightarrow{\left(4\right)}\) MgO \(\underrightarrow{\left(5\right)}\) MgSO4 \(\underrightarrow{\left(6\right)}\) MgCO3 \(\underrightarrow{\left(7\right)}\) MgO
\(\left(1\right)2Mg+O_2\underrightarrow{t^o}2MgO\)
\(\left(2\right)MgO+2HCl\rightarrow MgCl_2+H_2O\)
\(\left(3\right)MgCl_2+2NaOH\rightarrow Mg\left(OH\right)_2\downarrow+2NaCl\)
\(\left(4\right)Mg\left(OH\right)_2\underrightarrow{t^o}MgO+H_2O\)
\(\left(5\right)MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(\left(6\right)MgSO_4+Na_2CO_3\rightarrow MgCO_3+Na_2SO_4\)
\(\left(7\right)MgCO_3\underrightarrow{t^o}MgO+CO_2\uparrow\)

X: Fe3O4
Y: FeCl2
Z: FeCl3
T: Fe(OH)2
U: Fe(OH)3
A: NaCl (hoặc H2O)
B: H2O (hoặc NaCl)
D: H2 (hoặc Cl2)
E: Cl2 (hoặc H2)
F: NaOH
G: HCl
PTHH:
a) NaCl + H2O -dpmn----> 1/2 H2 + 1/2 Cl2 + NaOH
H2 + Cl2 -to-> 2 HCl
HCl + NaOH -> NaCl + H2O
b) 3 Fe +2 O2 -to->Fe3O4
Fe3O4 + 8 HCl -> FeCl2 +2 FeCl3 + H2O
FeCl2 + 2 NaOH -> Fe(OH)2 + 2 NaCl
FeCl3 +3 NaOH -> Fe(OH)3 + 3NaCl
Chúc em học tốt!



$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O(1)$
$Fe_2(SO_4)_3 + Fe\ to 3FeSO_4(2)$
Gọi $n_{Fe_2(SO_4)_3} = a(mol) ; n_{FeSO_4} = b(mol)$
Ta có : $400a + 152b = 62,8(1)$
$n_{SO_2} = 0,15(mol)$
$n_{Fe_2(SO_4)_3(1)} = \dfrac{1}{3}n_{SO_2} = 0,05(mol)$
$n_{Fe_2(SO_4)_3(2)} = \dfrac{1}{3}n_{FeSO_4} = \dfrac{b}{3}$
Suy ra:
$0,05 - \dfrac{b}{3} = a(2)$
Từ (1)(2) suy ra $a = \dfrac{45}{112} ; b = -1,055<0$
=> Sai đề

A là dung dịch H2SO4
B: Na2CO3
C: H2SO4 đặc
D: Xút (NaOH)
Khi cho DD H2SO4 tác dụng với Na2CO3 giải phóng khí SO2 mang theo hơi nước.
Bình C để giữ hơi nước lại trong bình (H2SO4 đặc háu nước) SO2 không tác dụng tiếp tục được dẫn qua bình đựng.
Để tránh SO2 thoát ra bên ngoài gây ô nhiễm môi trường và 1 số bệnh cho con người nên Xút được đặt ở miệng bình để tạo muối.

CuO + H2SO4 \(\rightarrow\)CuSO4 + H2O (1)
Cr2O3 + 3H2SO4 \(\rightarrow\)Cr2(SO4)3 + 3H2O (2)
Đặt nCuO=a
nCr2O3=b
Ta có :
\(\left\{{}\begin{matrix}80a+152b=69,2\\160a+392b=169,2\end{matrix}\right.\)
=>a=0,2;b=0,35
mCuO=80.0,2=16(g)
mCr2O3=69,2-16=53,2(g)
b;Theo PTHH 1 và 2 ta có:
nCuO=nH2SO4=0,2(mol)
3nCr2O3=nH2SO4=1,05(mol)
nCuO=nCuSO4=0,2(mol)
nCr2O3=nCr2(SO4)3=0,35(mol)
mH2SO4=(1,05+0,2).98=122,5(g)
mdd H2SO4=122,5:\(\dfrac{1,96}{100}=6250\left(g\right)\)
mCuSO4=0,2.160=32(g)
mCr2(SO4)3=392.0,35=137,2(g)
C% dd CuSO4=\(\dfrac{32}{6250+69,2}.100\%=0,5\%\)
C% dd Cr2(SO4)3=\(\dfrac{137,2}{6250+69,2}.100\%=2,17\%\)



 Giúp hộ mình nha !!!
Giúp hộ mình nha !!!

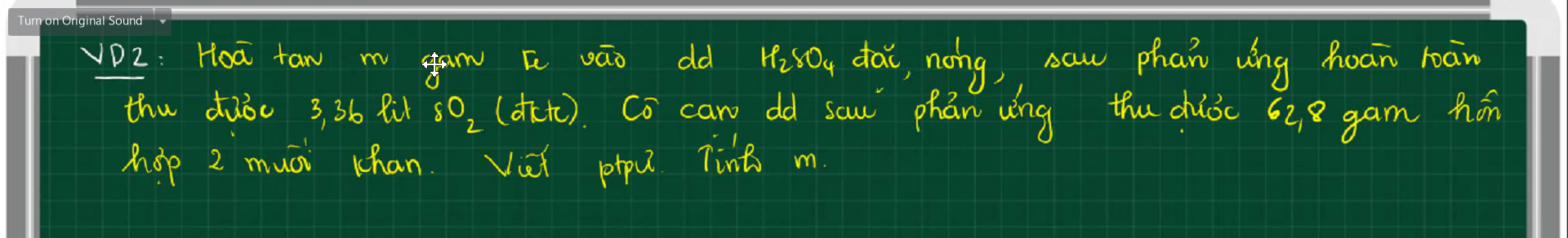

Gọi CTHH của oxit sắt cần tìm là FexOy
Khử toàn bộ oxit sắt bằng khí CO ta có phương trình sau
(1)\(Fe_xO_y+yCO\underrightarrow{t^o}xFe+yCO_2\uparrow\)
\(\Rightarrow\)Hỗn hợp khí A là CO dư và CO2.Chất rắn B là Fe
Dẫn toàn bộ khí A vào dd Ca(OH)2 ta có phương trình sau:
\(\left(2\right)CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
Đặt n\(CO_2\)=a(mol) ,theo (2)\(n_{CO_2}=n_{CaCO_3}=0,12\left(mol\right)\)
Ta có:\(m_{CaCO_3}-m_{CO_2}=100a-44a=6,72\left(g\right)\)
\(\Leftrightarrow a=0,12\left(mol\right)\)
Ta lại có:\(n_{O\left(trõngoxit\right)}=n_{CO_2}=0,12\left(mol\right)\)
\(\Leftrightarrow m_{Fe}=m_{Fe_xO_y}-m_{O\left(trongoxit\right)}=6,96-0,12.16=5,04\left(g\right)\)
\(\Leftrightarrow n_{Fe}=\dfrac{5,04}{56}=0,09\left(mol\right)\)
Ta thấy \(n_{Fe}:n_O=0,09:0,12=3:4\)
\(\Rightarrow\)Oxit sắt cần tìm là Fe3O4
Cho chất rắn B và dd hỗn hơp hai muối AgNO3 và Cu(NO3)2 ta có các phương trình hóa học sau:
\(\left(3\right)Fe+2AgNO_3\rightarrow2Ag\downarrow+Fe\left(NO_3\right)_2\)
\(\left(4\right)Fe+Cu\left(NO_3\right)_2\rightarrow Cu\downarrow+Fe\left(NO_3\right)_2\)
Ta có:\(n_{AgNO_3}=1,2.0,1=0,12\left(mol\right)\)
\(n_{Cu\left(NO_3\right)_2}=0,6.0,1=0,06\left(mol\right)\)
Giả sử Fe dư trong phản ứng (3) ta có
Theo\(\left(3\right)n_{Fe\left(3\right)}=\dfrac{1}{2}n_{AgNO_3}=0,06\left(mol\right)\)<\(0,09\left(mol\right)=n_{Fe\left(có\right)}\)
\(\Rightarrow\)Giả sử đúng,\(n_{Fe\left(dư\right)}=0,09-0,06=0,03\left(mol\right)\)
Giả sử Fe hết trong phản ứng (4)
Theo(4)\(n_{Cu\left(NO_3\right)_2\left(4\right)}=n_{Fe\left(dư\right)}=0,03\left(mol\right)< 0,06\left(mol\right)=n_{Cu\left(NO_3\right)_2\left(có\right)}\)
⇒Giả sử đúng,m(g) chất rắn thu đc sau phản ứng gồm Ag và Cu
Theo(3)\(n_{Ag}=n_{AgNO_3}=0,12\left(mol\right)\)
Theo(4)\(n_{Cu}=n_{Cu\left(NO_3\right)_2\left(4\right)}=0,03\left(mol\right)\)
\(\Rightarrow m=m_{Ag}+m_{Cu}=108.0,12+64.0,03=14,88\left(g\right)\)
Bài 3.1 mà bạn yêu cầu nek