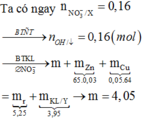Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
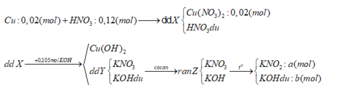
∑nKOH = a + b = 0,105 (1)
∑ mrắn = 85a + 56b = 8,78 (2)
Từ (1) và (2) => a = 0,1 (mol) ; b = 0,005 (mol)
nKNO3 tạo ra từ Cu(NO3)2 = 0,04 (mol)
=> nKNO3 tạo ra từ HNO3 dư = 0,1 – 0,04 = 0,06 (mo)
=> nHNO3 dư = 0,12- 0,06 = 0,06 (mol)
=> nHNO3 bị khử = 0,06 – 0,02.2 = 0,02 (mol)
Với ne( Cu nhường) = 2.nCu = 0,04 (mol) => Trung bình mỗi N+5 nhận 0,04/0,02 = 2e
=> Tạo NO2 (1e) và NO ( 3e)
=> nNO = nNO2 = 0,02/ 2= 0,01(mol)
Vậy mdd X = mCu + mdd HNO3 – m khí = 1,28 + 12,6 – 0,01.30 – 0,01.46 = 13,12 (g)
=> C% Cu(NO3)2 = [( 0,02.188) : 13,12].100% = 28,66%

Đáp án A
Ta có CM HNO3 = CM Cu(NO3)2
Vì thanh Fe còn dư ⇒ sản phẩm cuối cùng là Fe2+.
Ta có các pứ: 3Fe + 8HNO3 → 3Fe(NO3)2 + 2NO + 4H2O.
Sau đó: Fe + Cu(NO3)2 → Fe(NO3)2 + Cu↓.
Ta có: mGiảm = mFe – mCu = 56×( 3 a + a 8 + a) – 64a = 1,04.
<=> 13a = 1,04 <=> a = 0,08 mol.
⇒ nHNO3 = 0,08 ∑ne trao đổi = 0,08 mol ⇒ t = 0 , 08 × 96500 2 = 3860 giây.

a) Ta có: \(\left\{{}\begin{matrix}\left[Cu^{2+}\right]=C_{M_{Cu\left(NO_3\right)_2}}=0,3\left(M\right)\\\left[NO_3^-\right]=2C_{M_{Cu\left(NO_3\right)_2}}=0,6\left(M\right)\end{matrix}\right.\)
b) Ta có: \(n_{H_2SO_4}=\dfrac{4,9}{98}=0,05\left(mol\right)\) \(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,05}{0,2}=0,25\left(M\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\left[H^+\right]=0,5\left(M\right)\\\left[SO_4^{2-}\right]=0,25\left(M\right)\end{matrix}\right.\)

Đáp án B
Gọi công thức chung của các muối là M(NO3)2
nO = 50.0,5568 / 16 = 1,74 (mol)
=> nNO3 = 1/3 nO = 0,58 (mol)
=> mKL = mX – mNO3 = 50 – 0,58.62 = 14,04 (g)
Cu(NO3)2, Zn(NO3)2, Mg(NO3)2 cho qua KOH dư thì kết tủa thu được là Cu(OH)2 và Mg(OH)2 ( Do Zn(OH)2 tan trong KOH dư)
=> mOXIT = mMgO + mCuO
=> mOXIT < mCuO + mZnO + mMgO = mM + mO
=> mOXIT < 14,04 + 0,29.16 ( nO = ½ nNO3)
=> mOXIT < 18,68
Chỉ có đáp án B. 12,88 là phù hợp
Chú ý:
Zn(OH)2 tan trong KOH dư