
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


(1) \(2H_2Se+O_2\underrightarrow{t^o}2H_2O+2Se\)
(2) \(2Cu\left(NO_3\right)_2\underrightarrow{t^o}2CuO+4NO_2\uparrow+O_2\uparrow\)
(3) \(4Sn+8HCl+2HNO_3\rightarrow5H_2O+N_2O\uparrow+4SnCl_4\)
(4) \(3Cu_2S+6FeS_2+40HNO_3\rightarrow6CuSO_4+3Fe_2\left(SO_4\right)_3+40NO\uparrow+20H_2O\)

- Ở cùng điều kiện, nhiều chất khác nhau sẽ biến đổi hóa học nhanh, chậm khác nhau.
Ví dụ: Trong cùng một môi trường nhiệt độ phòng:
+ Quá trình oxi hóa sắt (cửa sắt) tạo gỉ sắt xảy ra chậm (vài tháng hoặc vài năm).
+ Quá trình oxi hóa thức ăn xảy ra nhanh (vài tiếng, 1 ngày hoặc vài ngày).
- Với cùng một chất, trong điều kiện khác nhau cũng biến đổi hóa học nhanh, chậm khác nhau.
Ví dụ: Rau được bảo quản trong tủ lạnh sẽ giữ được lâu hơn rau để bên ngoài.

Chất oxi hóa là chất nhận electron.
Sự oxi hóa một chất là làm cho chất đó nhường electron.
Chất khử là chất nhường electron.
Sự khử một chất là sự làm cho chất đó thu electron.
Thí dụ: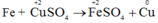
- Nguyên tử Fe nhường electron, là chất khử. Sự nhường electron của Fe được gọi là sự oxi hóa nguyên tử sắt.
- Ion đồng nhận electron, là chất oxi hóa. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.

Câu 29.
\(C_4H_{10}\rightarrow CH_4+C_3H_6\)
\(2CH_4\xrightarrow[1500^oC]{làmlạnhnhanh}C_2H_2+2H_2\uparrow\)
\(C_2H_2+HCl\xrightarrow[xtHgCl_2]{t^o,p}C_2H_3Cl\)
Câu 30.
\(n_{hh}=\dfrac{4,48}{22,4}=0,2mol\)
\(C_3H_4+2Br_2\rightarrow C_3H_4Br_4\)
\(n_{Br_2}=\dfrac{32}{160}=0,2mol\Rightarrow n_{C_3H_4}=0,1mol\)
\(\Rightarrow n_{CH_4}=0,2-0,1=0,1mol\)
a)\(\%m_{C_3H_4}=\dfrac{0,1\cdot40}{0,1\cdot40+0,1\cdot16}\cdot100\%=71,43\%\)
\(\%m_{CH_4}=100\%-71,43\%=28,57\%\)
b)Dẫn 4,48l hỗn hợp qua dung dịch \(AgNO_3\)/\(NH_3\) thì chỉ có \(C_3H_4\) phản ứng.
\(C_3H_4+AgNO_3+NH_3\rightarrow AgC\equiv C-CH_3\downarrow+NH_4NO_3\)
0,1 \(\rightarrow\) 0,1
\(m_{\downarrow}=0,1\cdot147=14,7g\)
Giúp mik hoàn thành phương trình nhé( với lại mik bấm lộn phải phương trình ko Pk trương trình đou)

\(c,Cl_2+Ca\left(OH\right)_2\underrightarrow{t^o}CaOCl_2+H_2O\\ d,2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\uparrow\\ h,Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\\ i,O_3+Ag\underrightarrow{t^o}Ag_2O+O_2\uparrow\)

\(2NaCl\underrightarrow{\text{điện phân nóng chảy}}2Na+Cl_2\uparrow\\ H_2+Cl_2\underrightarrow{\text{ánh sáng}}2HCl\\ Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\\ FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3\downarrow+3NaCl\)

- Trong bảng tuần hoàn, ô nguyên tố cho ta biết: số hiệu nguyên tử, kí hiệu nguyên tố, tên nguyên tố và nguyên tử khối trung bình,…
- Ví dụ: Ô nguyên tố nhôm

- Nhôm có số hiệu nguyên tử là 13
- Kí hiệu nguyên tố là Al
- Tên nguyên tố là nhôm
- Nguyên tử khối trung bình của nhôm là 26,982

Enthalpy tạo thành của một chất | Biến thiên enthalpy của phản ứng |
- Chất tham gia phải là đơn chất bền nhất - Sản phẩm chỉ có 1 chất duy nhất Ví dụ: H2(g) + Cl2(g) → 2HCl(g) | - Chất tham gia ở dạng đơn chất hay hợp chất đều được - Sản phẩm có thể là 1 hay nhiều chất Ví dụ: C(s) + H2O(g) \(\xrightarrow[]{t^o}\)CO(g) + H2(g) |


\(F_2+2KCl_{\left(rắn\right)}\underrightarrow{lạnh}2KF+Cl_2\)