Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

2) Kẽm + dd Axit clohidric ---> kẽm clorua + khí hidro
Zn + 2HCl ---> ZnCl2 + H2
BTKL: mZn + 6 = 13 + 7 ---> mZn = 14 g
1 , a , Axit sunfuric + natri hidroxit -> natri sunfat + nước

1/ nZn= 3.25/65=0.05 mol
Zn + 2HCl --> ZnCl2 + H2
0.05__0.1___________0.05
VddHCl= 0.1/0.5=0.2l
Đặt: nFe=nAl= x mol
Fe + H2SO4 --> FeSO4 + H2
x_____________________x
2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
x__________________________1.5x
nH2= x + 1.5x = 0.05
<=> x= 0.02
mFe= 0.02*56=1.12g
nAl= 0.02*27=0.54g
mhh= 1.12+0.54=1.66g
%Fe= 1.12/1.66*100%= 73.49%
%Al= 100-73.49=26.51%

a) PTHH là: 2Al + H2SO4 → Al2(SO4) + H2.
Tỉ lệ giữa số nguyên tử Al lần lượt với số phân tử của ba chất trong phản ứng đều là 2:1
b) nAl =27/27 = 1 (mol)
theo PTHH ta có: số mol của H2SO4 = 1/2 * nAl = 1/2*1 =0.5 (mol)
khối lượng của H2SO4 là: 0.5 * (1*2+32+16*4) =49 (g).

Giải
Theo định luật bảo toàn khối lượng, ta có:
mZn +mH2SO4 -> mZnSO4 + mH2
-> mH2SO4=(mZnSO4 + mH2) - mH2
-> mH2SO4=(40,25 + 0,5) - 16,25
-> mH2SO4= 24,5g
Vậy khối lượng H2SO4 cần dùng là 24,5g
CHÚC BẠN HỌC TỐT NHA ! ![]()
![]()
![]()
a)mZn+mH2SO4-ZnSO4+H2
b)Khối lượng H2SO4=24,5
Nhớ tick cho mik nếu như cảm thấy mik trả lời đúng nha![]()

 nè bạn...... cái khúc cuối là y=0,2 mol đó, b hc chuyên Hóa à?
nè bạn...... cái khúc cuối là y=0,2 mol đó, b hc chuyên Hóa à?
chà, chữ bạn đẹp quá đi mất, mình phải nhìn cả giờ đồng hồ đấy, lòi hết cả mắt rồi này^^

a,
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
b,
\(n_{H2}=0,6\left(mol\right)\)
\(n_{Al}=\frac{2}{3}n_{H2}=0,4\left(mol\right);n_{Zn}=0,6\left(mol\right)\)
\(m_{Al}=10,8\left(g\right);m_{Zn}=39\left(g\right)\)
c,
Giả sử dùng 100g mỗi kim loại
\(\Rightarrow n_{Al}=3,7\left(mol\right);n_{Zn}=1,5\left(mol\right)\)
3,7 mol Al tạo 5,55 mol H2
1,5 mol Zn tạo 1,5 mol H2
Vậy cùng khối lượng kim loại nhưng Al cho nhiều H2 hơn.

a) Phương trình phản ứng:
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4loãng → FeSO4 + H2
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2
b) Giả sử cho cùng một khối lượng là a g kim loại kẽm sắt và nhôm
Zn + H2SO4 → ZnSO4 + H2 (1)
Fe + H2SO4loãng → FeSO4 + H2 (2)
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2 (3)
Ta có 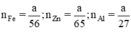
Theo pt nH2 (1) = nZn = 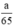 mol
mol
nH2 (2) = nFe = 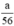 mol
mol
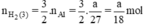
Như vậy ta nhận thấy 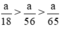 ⇒ nH2 (3) > nH2 (2) > nH2 (1)
⇒ nH2 (3) > nH2 (2) > nH2 (1)
Như vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.

PTHH: 2Al + 6HCl -> 2AlCl3 + 3H2 (1)
Zn + 2HCl -> ZnCl2 + H2 (2)
Gọi khối lượng của kim loại Al và Zn là x.
\(=>n_{Al\left(1\right)}=\dfrac{x}{27}\left(mol\right)\\ n_{Zn\left(2\right)}=\dfrac{x}{65}\left(mol\right)\)
Theo các PTHH và đb, ta có:
\(n_{H_2\left(1\right)}=\dfrac{3.n_{Al\left(1\right)}}{2}=\dfrac{3.\dfrac{x}{27}}{2}=\dfrac{x}{18}\left(mol\right)\\ n_{H_2\left(2\right)}=n_{Zn\left(2\right)}=\dfrac{x}{65}\left(mol\right)\)
Vì: \(\dfrac{x}{18}>\dfrac{x}{65}\\ =>n_{H_2\left(1\right)}>n_{H_2\left(2\right)}\)
=> \(V_{H_2\left(1\right)}>V_{H_2\left(2\right)}\)
Vậy: Cùng một khối lượng Al, Zn cho tác dụng với axit HCl thì dùng kim loại Al sẽ thu dược lượng khi H2 nhiều hơn.

a/ PTHH: Zn + 2HCl ===> ZnCl2 + H2
b/Tỉ lệ: 1 : 2 : 1 : 1
c/ nZn = 65 / 65 = 1 mol
=> nZnCl2 = nH2 = nZn = 1 mol
=> mZnCl2 = 1 x 136 = 136 gam
mH2 = 1 x 2 = 2 gam
Giả sử mZn = mAl = a (g)
\(n_{Zn}=\dfrac{a}{65}\left(mol\right)\); \(n_{Al}=\dfrac{a}{27}\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2 (1)
=> \(n_{H_2\left(1\right)}=\dfrac{a}{65}\left(mol\right)\)
2Al + 3H2SO4 -->Al2(SO4)3 + 3H2
=> \(n_{H_2\left(2\right)}=\dfrac{a}{18}\left(mol\right)\)
Có \(n_{H_2\left(1\right)}< n_{H_2\left(2\right)}\)
=> Nhôm cho nhiều H2 hơn