


Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




a, PTHH: 2Mg + O2 ---to→ 2MgO
b, Theo ĐLBTKL ta có:
\(m_{Mg}+m_{O_2}=m_{MgO}\)
c, \(m_{Mg}+m_{O_2}=m_{MgO}\Leftrightarrow m_{O_2}=m_{MgO}-m_{Mg}=15-9=6\left(g\right)\)

- Phản ứng (1): diễn ra giữa chất rắn và chất khí, có sự đốt cháy
- Phản ứng (2): diễn ra giữa chất rắn và chất khí, không có đốt cháy
=> Phản ứng (1) diễn ra nhanh hơn phản ứng (2)
- Phản ứng (3): diễn ra giữa chất khí và chất khí, có sự đốt cháy
=> Phản ứng (3) diễn ra nhanh hơn phản ứng (1)
=> Tốc độ phản ứng theo chiều tăng dần: (2) < (1) < (3)

PT:
Fe + S-->FeS (to)
FeS + H2SO4-->H2S + FeSO4
Vai trò:chất oxi hóa

Theo đề bài ta có bột S dư nên Fe, Zn tác dụng hết với S.
a)Phương trình hóa học của phản ứng.
Zn + S -> ZnS Fe + S -> FeS
x mol x mol y mol y mol
ZnSO4 + H2SO4 -> ZnSO4 + H2S
x mol x mol
FeSO4 + H2SO4 -> FeSO4 + H2S
x mol y mol
Ta có hệ phương trình :
Giải hệ phương trình => x = 0,04 (mol), y = 0,02 (mol).
Vậy mZn = 0,04.65 = 2,6g
mFe = 0,02.56 = 1,12g.

Chọn A
Cách 1:
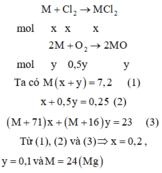
Cách 2:
Gọi số mol của Cl2 và O2 phản ứng lần lượt là x và y mol
→ nkhí = 0,25 mol → x + y = 0,25 (1)
Bảo toàn khối lượng có mkhí= 23 – 7,2= 15,8 gam
→ 71x + 32y = 15,8 (2)
Từ (1) và (2) → x = 0,2 và y = 0,05
Bảo toàn electron có:
2.nM = 2.nCl2 + 4.nO2 → nM= 0,3 → MM = 7,2 : 0,3 = 24 (g/mol)
Vậy kim loại M là Mg.

a)Phương trình:
Zn+S→ZnS; Fe+S→FeS
ZnS+H2SO4→ZnSO4+H2S
FeS+H2SO4→FeSO4+H2S
b)Gọi m, m' là khối lượng Zn, Fe trong hỗn hợp ban đầu
m+m' = 3,72
nH2S=nZnS+nFeS=nZn+nFe=m/65+m'/56
=1,344/22,4=0,06
Bấm máy giải hệ phương trình:
m+m' = 3,72
(1/65).m+(1/56).m' = 0,06
ta được nghiệm: m = 2,6 ; m' = 1,12VV