Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi CTHH của A là CxHy
PTK của A=8.2=16(dvC)
x=\(\dfrac{16.75\%}{12}=1\)
y=\(\dfrac{16-12}{1}=4\)
Vậy CTHH của A là CH4
MA=8.MH2 = 8.2 =16( đvC)
gọi công thức của A là: CxHy
%C= \(\dfrac{x.12}{16}\).100=75% => x=1
%H= \(\dfrac{y.1}{16}\).100=25% => y=4
=> công thức hợp chất A là CH4

a) MA = 32.2 = 64(g/mol)
\(m_S=\dfrac{64.50}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_O=64-32=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> CTHH: SO2
b) MA = 2.17 = 34 (g/mol)
\(m_H=\dfrac{34.5,88}{100}=2\left(g\right)=>n_H=\dfrac{2}{1}=2\left(mol\right)\)
\(m_S=34-2=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
=> CTHH: H2S

Ta có: = 17 => MA = 17 . 2 = 34
Khối lượng của mỗi nguyên tố có trong 1 mol khí A
=> mH = = 2 (g) => mS =
= 32 (g)
hoặc mS = 34 - 2 = 32 (g)
Số mol nguyên tử của mỗi nguyên tố trong 1 mol khí A:
nH = = 2 mol nS =
= 1 mol
Suy ra trong 1 phân tử hợp chất A có 2 nguyên tử H và 1 nguyên tử S. Do đó công thức hóa học của khí A là H2S
Ta có: = 17 => MA = 17 . 2 = 34
Khối lượng của mỗi nguyên tố có trong 1 mol khí A
=> mH = = 2 (g) => mS =
= 32 (g)
hoặc mS = 34 - 2 = 32 (g)
Số mol nguyên tử của mỗi nguyên tố trong 1 mol khí A:
nH = = 2 mol nS =
= 1 mol
Suy ra trong 1 phân tử hợp chất A có 2 nguyên tử H và 1 nguyên tử S. Do đó công thức hóa học của khí A là H2S

\(CTTQ:Fe_xO_y\)
Ta có: \(\frac{\%Fe}{56}:\frac{\%O}{16}=x:y\)
\(\Leftrightarrow\frac{70}{56}:\frac{30}{16}=x:y\)
\(\Leftrightarrow\frac{5}{4}:\frac{15}{8}=x:y\)
\(\Leftrightarrow\frac{x}{y}=\frac{10}{15}=\frac{2}{3}\)
\(\Rightarrow CTHH:Fe_2O_3\)
Gọi CTHH là FexOy, ta có:
\(\frac{\%Fe}{\%O}=\frac{56x}{16y}=\frac{70\%}{30\%}=\frac{70.16}{56.30}=\frac{2}{3}\)
=> x=2;y=3
Vậy CTHH là Fe2O3.

MX = 17.2 = 34 (g/mol)
\(m_S=\dfrac{94,12.34}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_H=\dfrac{5,88.34}{100}=2\left(g\right)=>n_H=\dfrac{2}{1}=2\left(mol\right)\)
=> CTHH: H2S

\(M_A=17\cdot2=34\left(\dfrac{g}{mol}\right)\)
\(CT:H_xS_y\)
\(\%H=\dfrac{x}{34}\cdot100\%=5.88\%\)
\(\Rightarrow x=2\)
\(\%S=\dfrac{32y}{34}\cdot100\%=94.12\%\)
\(\Rightarrow y=1\)
\(CTHH:H_2S\)
\(M_A=17.M_{H_2}=34\left(đvC\right)\\ GọiCTcủakhíAlàH_xS\\ Tacó:\%H=\dfrac{x}{34}.100=5,88\%\\ \Rightarrow x=2\\ VậyCTHHcủaA:H_2S\)

câu 4
MX= 8,5.2 = 17
gọi công thức NxHy
=> x:y = \(\frac{82,35}{14}:\frac{17,65}{1}=1:3\)
=> NH3

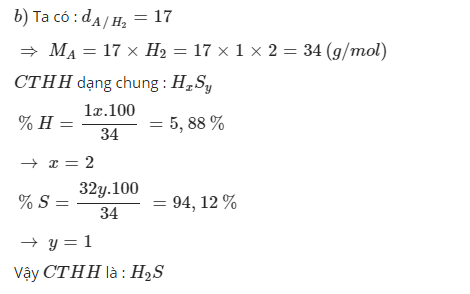
Ta có: dA/H2d = MA\MH2
=> 17 = MA\2
=> MA = 17. 2 = 34 (g/mol)
Do đó: mH = 5.88.34\100 = 2 (g)
mS = 34 - 2 = 32 (g)
Suy ra: nH = 2\1 = 2 (mol)
nS = 32\32 = 1 (mol)
Vậy trong một phân tử A có 2 nguyên tử H, 1 nguyên tử S
Công thức hóa học của A là H2S