Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phương trình hóa học của phản ứng:
Cl2 + 2NaI → 2NaCl + I2
71g (2 x 127)g
X g 12,7g
X = 3,55g
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
(4 x 36,5g) 71g
Y g 3,55 g
Y = 7,3g
Khối lượng HCl cần dùng là 7,3g

a/
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(3Cl_2+2Fe\underrightarrow{^{to}}2FeCl_3\)
\(FeCl_3+3NaOH\rightarrow3NaCl+Fe\left(OH\right)_3\)
\(2NaCl+H_2SO_4\underrightarrow{^{to}}Na_2SO_4+2HCl\)
\(HCl+CuO\rightarrow CuCl_2+H_2O\)
\(CuCl_2+AgNO_3\rightarrow AgCl+Cu\left(NO_3\right)2\)
b/
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(Cl_2+2Na\underrightarrow{^{to}}2NaCl\)
\(2NaCl+H_2SO_{4_{dac}}\underrightarrow{^{to}}Na_2SO_4+2HCl\)
\(2HCl+Fe\rightarrow FeCl_2+H_2\)
c/
\(MnO_2+4HCl_đ\underrightarrow{^{to}}MnO_2+Cl_2+2H_2O\)
\(Cl_2+2K\underrightarrow{^{to}}2KCl\)
\(2KCl+H_2SO_4\underrightarrow{^{to}}K_2SO_4+2HCl\)
\(2HCl\underrightarrow{^{đpdd}}H_2+Cl_2\)
\(Cl_2+2NaBr\rightarrow2NaCl+Br_2\)
\(Br_2+2NaI\rightarrow NaBr+I_2\)
d/
\(2KMnO_4+16HCl_đ\underrightarrow{^{to}}2KCl+2MnCl_2+5Cl_2+8H_2O\)
\(Cl_2+H_2\underrightarrow{^{as}}2HCl\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(FeCl_3+3AgNO_3\rightarrow3AgCl+Fe\left(NO_3\right)_3\)

a)
Giả sử lấy lượng mỗi chất là a gam.
MnO2 + 4HCl \(\rightarrow\) MnCl2 + Cl2 + 2H2O (1)
2KMnO4 + 14 HCl \(\rightarrow\)2MnCl2 + 2KCl + 5Cl2 + 8H2O (2)
K2Cr2O7 + 14 HCl \(\rightarrow\)2CrCl2 + 2KCl + 3Cl2 + 7H2O (3)
Vậy dùng : KMnO4 điều chế được nhiều Cl2 hơn
b) Nếu số mol các chất bằng n mol
Theo (1) nmol MnO2 \(\rightarrow\) nmol Cl2
Theo (2) nmol KMnO4 \(\rightarrow\) 2,5 nmol Cl2
Theo (3) nmol K2Cr2O7 \(\rightarrow\) 3nmol Cl2
Ta có: 3n > 2,5n > n
Vậy dùng K2Cr2O7 được nhiều hơn Cl2 hơn
Clo oxi hóa dễ dàng Br – tronh dung dịch muối bromua và I- trong dung dịch muối iotua.
Cl2 + 2NaBr \(\rightarrow\) 2NaCl + Br2
Cl2 + 2NaI \(\rightarrow\) 2NaCl + I2

a) (1) MnO2 + 4 HCl(đặc) -to-> MnCl2 + Cl2 + 2 H2O
(2) Cl2 + H2 \(\Leftrightarrow\) 2 HCl
(3) HCl + NaOH -> NaCl + H2O
(4) 2 NaCl + 2 H2O -đpddcmnx-> 2 NaOH + H2 + Cl2
(5) Cl2 + 2 H2O + SO2 -> H2SO4 + 2 HCl
(6) H2SO4 + BaCl2 -> BaSO4 + 2 HCl
b)
(1) BaCl2 -điện phân nóng chảy nhiệt độ cao-> Ba + Cl2
(2) Cl2 + H2 \(\Leftrightarrow\) 2 HCl
(3) Fe + 2 HCl -> FeCl2 + H2
(4) 2 FeCl2 + Cl2 -to-> 2 FeCl3
(5) 2 FeCl3 + 3 Ba(OH)2 -> 2 Fe(OH)3 +3 BaCl2
(6) BaCl2 + H2SO4 -> BaSO4 + 2 HCl
c) (1) BaCl2 + H2SO4 -> BaSO4 +2 HCl
(2) 2 HCl + CuO -> CuCl2 + H2O
(3) CuCl2 + 2 KOH -> Cu(OH)2 + 2 KCl
(4) KCl + H2O -đpddcmnx-> KOH + 1/2 Cl2 + 1/2 H2
(5) 6 KOH + 3 Cl2 -to->5 KCl + KClO3 +3 H2O
(6) 2 KClO3 -to-> 2 KCl + 3 O2
a)
(1) MnO2 + 4HCl(đ) -to-> MnCl2 + Cl2 + 2H2O
(2) Cl2 + H2 <-as-> 2 HCl
(3) HCl + NaOH => NaCl + H2O
(4) 2NaCl + 2H2O -đpddcmn-> 2NaOH + H2 + Cl2
(5) Cl2 + 2H2O + SO2 => H2SO4 + 2HCl
(6) H2SO4 + BaCl2 => BaSO4 + 2HCl
b)
(1) BaCl2 -đpdd-> Ba + Cl2
(2) Cl2 + H2 ⇔ 2HCl (Đk : ánh sáng hoặc nhiệt độ)
(3) Fe + 2HCl => FeCl2 + H2
(4) 2FeCl2 + Cl2 -to-> 2FeCl3
(5) 2FeCl3 + 4Ba(OH)2 => 2Fe(OH)3 + 3BaCl2
(6) BaCl2 + H2SO4 => BaSO4 + 2HCl
c)
(1) BaCl2 + H2SO4 => BaSO4 +2HCl
(2) 2HCl + CuO => CuCl2 + H2O
(3) CuCl2 + 2KOH => Cu(OH)2 + 2KCl
(4) 2KCl + 2H2O -đpddcmn-> 2KOH + Cl2 + H2
(5) 6KOH + 3Cl2 -to-> 5KCl + KClO3 +3H2O
(6) 2KClO3 -to-> 2KCl + 3O2

Những phản ứng sau là phản ứng oxi hóa khử:
.jpg)
.png)
Cl2 vừa là chất khử vừa là chất oxi hóa.
b) .png) + 2HCl \(\rightarrow\) CaCl2 + Cl2 + H2O
+ 2HCl \(\rightarrow\) CaCl2 + Cl2 + H2O
CaOCl2: phân tử tự oxi hóa khử, HCl đóng vai trò môi trường
.jpg)
.png) Cl2 vừa là chất oxi hóa, vừa là chất khử.
Cl2 vừa là chất oxi hóa, vừa là chất khử.
.jpg)
.png)
HCl là chất khử, KClO3 là chất oxi hóa
.jpg)

CaOCl2: phân tử tự oxi hóa

Lời giải.
a) Khí hiđro sunfua H2S và khí lưu huỳnh đioxit SO2 không cùng tồn tại trong một bình chứa vì H2S là chất khử mạnh, SO2 là chất oxi hóa.
2H2S + SO2 -> 3S + 2H2O.
b) Khí oxi O2 và khí Cl2 có thể tồn tại trong một bình chứa vì O2 không tác dụng trực tiếp với Cl2.
c) Khí HI và Cl2 không tồn tại trong cùng một bình chứa vì Cl2 là chất oxi hóa mạnh và HI là chất khử mạnh.
Cl2 + 2HI -> 2HCl + I2.

Những cặp chất xảy ra phản ứng oxi hoá - khử :
(1)
(2) MnO2 + 4HCl > MnCl2 + Cl2 + 2H2O
b) Trong phản ứng (1) :
- Nguyên tử hiđro nhường electron là chất khử, sự nhường electron của H2 được gọi là sự oxi hoá nguyên tử hiđro.
- Ion đồng nhận electron, là chất oxi hoá. Sự nhận electron của ion đồng được gọi là sự khử ion đồng.
Trong phản ứng (2) :
- Ion Clo nhường electron là chất khử. Sự nhường electron của Cl được gọi là sự oxi hoá ion clo.
- Ion Mn nhận electron là chất oxi hoá. Sự nhận electron của ion Mn được gọi là sự khử ion Mn.
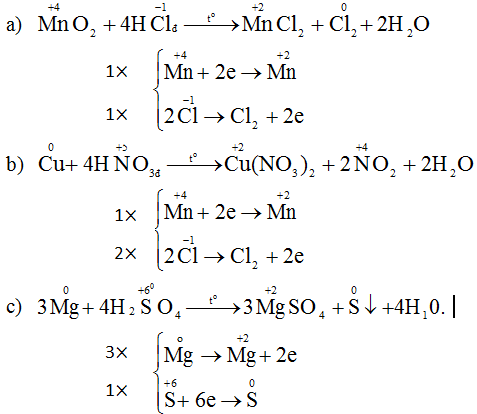
Đáp án B
Phương trình hóa học của phản ứng
Cl2 + 2NaI → 2NaCl + I2
0,05 ← 0,05 (mol)
nIot = 0,05 mol
4HCl + MnO2 → MnCl2 + Cl2 + 2H2O
0,2 ← 0,05 (mol)
Khối lượng HCl cần dùng là: mHCl = 0,2 x 36,5 = 7,3g