Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(Al_2O_3\\ n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\ \Rightarrow n_O=\dfrac{3}{2}.0,2=0,3\left(mol\right)\\ m_{Al_2O_3}=0,2.27+0,3.16=10,2\left(g\right)\)

Phương trình hóa học:
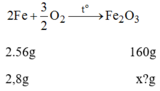
Khối lượng F e 2 O 3 ứng với lượng sắt trên là:
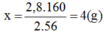
→ Chọn C.

1 mol sắt 3 oxit năng 160g chứa 112g Fe
=>với 2,8g fe thì khối lượng oxit là 2,8*160/112

Câu 1 :
mFe2O3 ( A ) = 0.6 tấn
mFe = (0.6/160)*112= 0.42 tấn
mFe3O4 ( B) = 0.696 tấn
mFe ( 0.696/232)*168= 0.504 tấn
=> Quặng B chứa nhiều sắt hơn
m = 0.504 - 0.42 = 0.084 tấn
Câu 2 :
Chọn tỉ lệ là : 2, 5
Trộn 2 tấn quặng A với 5 tấn quặng B thu được 7 tấn quặng C :
mFe ( C) = 2*0.42 + 5*0.504=3.36 tấn
Vậy trong 1 tấn quặng C có : 3.36/7 = 0.48 tấn

%mFe trong Fe2O3:
\(\frac{56.2}{160}.100=70\%\)
=> %mFe trong quặng:
%mFe = 70% . 82%= 57,4%
Vậy: Trong 1 mẫu quặng Fe chiếm 57,4%.
1 loại quặng sắt thành phần chủ yếu là fe2o3 . tính khối lượng sắt có trong 1 tấn quặng fe203. biết rằng lượng sắt trong quặng là 70%
1 loại quặng có chứa 50% Fe2O3. Khi phân tích a (gam) quặng này người ta thu được 2,8 gam Fe. Tính a

% khối lượng Fe trong Fe2O3 là:
\(\dfrac{56.2}{56.2+16.3}.100=70\%\)
Để thu được 2,8g Fe thì số g Fe2O3 cần dùng là:
2,8 : 70% = 4 (g)
\(\Rightarrow\) a = 4 : 50% = 8 (g)
Vậy a = 8.

Khối lường Fe3O4 có trong 1 tấn quặng là :
mFe3O4 = 1 x 90% = 0,9 ( tấn )
Khối lượng Fe trong Fe3O4 chiếm :
% Fe = 3 x 56 / ( 3x 56 + 4 x 16 ) = 72,41 %
Khối lượng Fe có trong 1 tấn quặng là :
mFe = 0,9 x 72,41%= 0,6517 ( tấn )
Khối lượng Fe3O4 trong 1 tấn quặng manhetit:
1: 100x90=0,9 (tấn)= 900 kg
\(\%m_{Fe}=\frac{3.M_{Fe}.100\%}{M_{Fe_3O_4}}=\frac{3.56.100}{232}\approx72,414\%\)
Khối lượng Fe:
900. 72,414%=651,726(kg)
nFe=m/M=2,8/56=0,05(mol)
pt: 4Fe + 3O2 --t0-> 2Fe2O3
cứ: 4..........3...............2 (mol)
vậy: 0,05---------------->0,025(mol)
=> mFe2O3=n.M=0,025.160=4(g
Ta có nFe = \(\dfrac{2,8}{56}\) = 0,05 ( mol )
Fe2O3 + 3H2 → 2Fe + 3H2O
0,025......................0,05
=> mFe2O3 = 0,025 . 160 = 4 ( gam )