Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Khi cho dung dịch K2CO3 vào dung dịch X thì có các phản ứng:
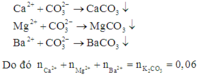
Áp dụng định luật bảo toàn điện tích cho dung dịch X ta có:
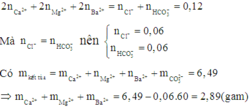
Khi đun nóng dung dịch X rồi nung trong không khí đến khối lượng không đổi thì có các phản ứng:
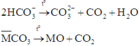
Với M là công thức chung của Ca, Mg và Ba.
Do đó chất rắn khan thu được cuối cùng chứa Ca2+, Mg2+, Ba2+, Cl-, O2- (trong oxit) với
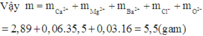

Đáp án B
-Cho ½ dung dịch X phản ứng với dung dịch NaOH dư
HCO3-+ OH- →CO32-+ H2O
Ca2++ CO32- dư →CaCO3
0,02 0,02
- Cho ½ dung dịch X phản ứng với dung dịch Ca(OH)2 dư
HCO3-+ OH- →CO32-+ H2O
0,045 0,045
Ca2++ CO32- →CaCO3
0,045 0,045
Dung dịch X có 0,07 mol Cl-; 0,04 mol Ca2+; 0,09 mol HCO3-; 0,08 mol Na+
Đun sôi dung dịch X thì: 2HCO3- → CO32-+ H2O + CO2
0,09 0,045 0,045 0,045
m = (0,07.35,5+0,04.40+ 0,09.61+ 0,08.23-0,045.18-0,045.44) = 8,625 gam

Theo định luật bảo toàn điện tích: 0,02.3+ 0,03.2=x + 2y
mmuối= 0,02.27+ 0,03.56 + 35,5.x+ 96.y=7,23
Suy ra x=0,06; y=0,03
Ta có: 2 cation: 0,02 mol Al3+, 0,03 mol Fe2+ và 2 anion: 0,06 mol Cl-, 0,03 mol SO42-
Suy ra 2 muối là FeCl2 và Al2(SO4)3

Đáp án A
Đặt Ca2+: a mol có trong 1/2dung dịch
Na+: b mol
HCO3-: c mol
Cl-: 2b mol
1/2 dung dịch X tác dụng NaOH dư
HCO3- + OH- → CO32- + H2O
c c
CO32- + Ca2+ → CaCO3
c a 0,04
1/2 dung dịch X tác dụng Ca(OH)2 dư
HCO3- + OH- → CO32- + H2O
c c
CO32- + Ca2+ → CaCO3
c c = 0,05
Ta có: nCaCO3↓ lần đầu = 0,04 mol và sau = 0,05
=> c = 0,05 mol và a = 0,04
Bão toàn mol điện tích ta có: 2a + b = c + 2b => b = 0,03
Đun sôi dung dịch đến cạn
2HCO3− → H2O + CO2 + CO32−
0,05 → 0,025
m chất rắn =(40a + 23b + 60c/2 + 35,5 . 2 . 0,03) . 2 = 11,84g

Ta có
Bảo toàn điện tích
0,1.1+0,2.2>0,05+0,36
\(\rightarrow\) Kết quả trên sai
Giả sử Cl- được xác định đúng
nHCO3-=0,14 mol
HCO3- \(\rightarrow\)CO32-+H+
0,14____0,14
m chất rắn=50,88<43,6
\(\rightarrow\) HCO3- được xác định đúng