
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Viết các phương trình phản ứng xảy ra (nếu có) khi lần lượt cho các cặp chất sau tác dụng với nhau:
2NaCl + ZnBr2 = 2NaBr + ZnCl2
| AgNO3 | + | KCl | → | AgCl | + | KNO3 |
2NaCl + I2 = 2NaI + Cl2
KF + AgNO3 = AgF + KNO3
2CuSO4 + 4KI = 2CuI + I2 + 2K2SO4
| Cl2 | + | 2KBr | → | Br2 | + | 2KCl |
| NaOH | + | HBr | → | H2O | + | NaBr |
2AgNO3 + ZnBr2 = 2AgBr + Zn(NO3)2
ZnBr2 + Pb(NO3)2 = Zn(NO3)2 + PbBr2
| Cl2 | + | 2KI | → | I2 | + | 2KCl |
| 2HCl | + | Fe(OH)2 | → | FeCl2 | + | 2H2O |
| CaCO3 | + | 2HCl | → | H2O | + | CO2 | + | CaCl2 |
| FeO | + | 2HCl | → | FeCl2 | + |
H2O
|
||||||||||
|
||||||||||||||||
|
|

Đáp án C
K2SO3 và NaHSO3 tan trong dung dịch H2SO4 và giải phóng khí:
K2SO3 + H2SO4 ® K2SO4 + SO2 + H2O
2KHSO3 + H2SO4 ® K2SO4 + 2SO2 + 2H2O
Na2SO4 tan trong dung dịch H2SO4 loãng (vì Na2SO4 tan trong nước của dung dịch H2SO4) và không phản ứng với H2SO4
NaOH tan trong dung dịch H2SO4 theo phương trình hoá học sau:
2NaOH + H2SO4 ® Na2SO4 + 2H2O
Các chất rắn tan trong dung dịch H2SO4 loãng và giải phóng khí là K2SO3 và NaHSO3

\(nSO_2=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
\(nKOH=\dfrac{0,4}{2}=0,2\left(mol\right)\)
\(SO_2+2KOH\rightarrow K_2SO_3+H_2O\)
=> dd X có những chất tan gồm K2SO3 và KOH.
\(n_{SO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ n_{KOH}=0,4.2=0,8\left(mol\right)\)
Xét \(T=\dfrac{0,8}{0,3}=\dfrac{8}{3}>2\) => phản ứng tạo muối trung hoà và có dư KOH
=> dd sau phản ứng gồm K2SO3 và KOH

Đáp án A
Cho H2O lần lượt vào các mẫu thử trên
- Mẫu thử không tan trong nước là CaCO3
- Các mẫu thử còn lại ta: NaCl, Na2S, K2SO3, Na2SO4
Cho dung dịch HCl dư lần lượt vào các mẫu thử tan.
- Mẫu thử tạo khí mùi trứng thối là Na2S
Na2S +2 HCl → 2NaCl + H2S↑
- Mẫu thử tạo khí mùi hắc là K2SO3
K2SO3 +2 HCl → 2KCl+ SO2↑+ H2O
- Hai chất không có hiện tượng gì là : NaCl và Na2SO4 (nhóm 1)
Cho dung dịch HCl dư vào chất không tan trong nước, sau đó lây dung dịch vừa thu được lần lượt tác dụng với 2 chất nhóm 1.
- Mẫu thử tạo kết tảu trắng là Na2SO4
CaCl2 + Na2SO4 → CaSO4 + 2NaCl
- Mẫu thử không có hiện tượng gì là NaCl

Mọi sự vật đều là sự thống nhất giữa lượng và chất, sự thay đổi dần dần về lượng trong khuôn khổ của độ tới điểm nút sẽ dẫn đến sự thay đổi về chất của sự vật thông qua bước nhảy; chất mới ra đời tác động trở lại sự thay đổi của lượng mới. Quá trình tác động đó diễn ra liên tục làm cho sự vật không ngừng phát triển, biến đổi.
Sự vận động và phát triển của sự vật bao giờ cũng diễn ra bằng cách tích lũy dần dần về lượng đến một giới hạn nhất định, thực hiện bước nhảy để chuyển về chất và việc học tập của sinh viên chúng ta cũng sẽ không thể nằm ngoài điều đó. Để có một tấm băng Đại học chúng ta phải tích lũy đủ số lượng các học phần và để học phần có kết quả tốt chúng ta cần phải tích lỹ đủ sống lượng đơn vị học trình của các môn học. Như vậy các kỳ thi có thể coi thời gian học là độ, các kỳ thi là các điểm nút và kết quả kỳ thi đạt yêu cầu là bước nhảy, bởi kết quả kỳ thi tốt - bước nhảy là sự kết thúc một giai đoạn tích lỹ tri thức trong quá trình học tập rèn luyện của chúng ta.
Do đó, trong hoạt động nhận thức, hoạt động học tập sinh viên phải biết từng bước tích lũy về lượng (tri thức) để làm biến đổi về chất (Kết quả học tập) theo quy luật. Cũng như trong hoạt động của mình ông cha ta chẳng thường có câu "tích tiểu thành đại". "năng nhặt, chặt bị" đó sao?
Những việc làm vĩ đại của con người bao giờ cũng là sự tổng hợp của những việc làm bình thường của con người đó. Quy luật này giúp chúng ta tránh được tư tưởng chủ quan trong học tập và trong hoạt động thực tiễn hằng ngày.
Ngắn gọn là: Chất có ở khắp mọi nơi. Ở đâu có vật thể ở đó có chất.

\(SO_2+2KOH\rightarrow K_2SO_3+H_2O\)
\(n_{KOH}=2.0,2=0,4\left(mol\right)\)
\(\Rightarrow n_{K_2SO_3}=\frac{0,4.1}{2}=0,2\left(mol\right)\)
\(\Rightarrow m_{K_2SO_3}=0,2.158=31,6\left(g\right)\)
#trannguyenbaoquyen

Quá trình khử : (S0 + 2 e ---> S-2 ) * 2
Quá trình OXH: (S0 ---> S+4 + 4e) *1
--> 3S0 ---> 2 S-2 + S+4
----> 3S + 4 KOH ---> 2 K2S + K2SO3 + 2 H2O
S + KOH -> K2S + K2SO3 + H2O
1x | \(S^0\rightarrow S^{+4}+4e\)
2x |\(S^0+2e\rightarrow S^{-2}\)
\(\Rightarrow\) 3S + 6KOH -> 2K2S + K2SO3 + 3H2O
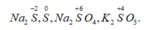

Kali cacbonat (K2CO3) là một muối trắng, hòa tan trong nước (không tan trong ethanol[1]), tạo thành một dung dịch kiềm mạnh.Nó là chất hóa học chảy rửa, thường hiện diện trong dạng chất rắn ẩm hoặc ướt. Kali cacbonat được sử dụng trong sản xuất xà phòng và thủy tinh