Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có : n N 2 n H 2 = 2 3
=> H2 thiếu, hiệu suất phản ứng tính theo H2.
Chọn n N 2 = 2 m o l n H 2 = 3 m o l
nH2 pư = 3 . 40% = 1,2 mol,
n N2 phản ứng = 0,4 mol
n NH3 sinh ra =0,8 mol.
n Y = n X - 0 , 8 = 2 + 3 - 0 , 8 = 4 , 2 m o l
Bảo toàn khối lượng :
![]()
Vậy tỉ khối của Y với H2 là 7,38

Gọi mol N2; H2 ban đầu là a, b
\(\overline{M_X}=3.2=6\)
\(\Rightarrow\frac{28a+2b}{a+b}=6\)
\(\Rightarrow22a=4b\)
\(\Rightarrow\frac{a}{b}=\frac{2}{11}\)
Giả sử a=2; b= 11
\(N_2+3H_2⇌2NH_3\)
Gọi x là mol N2 phản ứng => H2 phản ứng 3x mol. Tạo 2x mol NH3
=> Y chứa 2-x mol N2, 11-3x mol H2, 2x mol NH3
\(\Rightarrow\frac{28\left(2-x\right)+2\left(11-3x\right)+17.2x}{2-x+11-3x+2x}=8\)
\(\Rightarrow x=6,125\)
\(\Rightarrow H=\frac{1,625.100}{2}=81,25\%\)

Chọn C
Áp dụng sơ đồ đường chéo cho hỗn hợp N2 và H2 ta có :
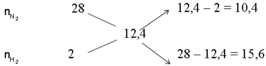
![]()
Với tỉ lệ trên suy ra H2 thiếu, hiệu suất phản ứng tính theo H2.
Trong hỗn hợp X ta chọn n N 2 = 2 n H 2 = 3
Số mol H2 phản ứng là 3.40% = 1,2 mol, suy ra số mol N2 phản ứng là 0,4 mol, số mol NH3 sinh ra là 0,8 mol. Sau phản ứng số mol khí giảm là (1,2 + 0,4) – 0,8 = 0,8 mol.
Sau phản ứng số mol khí giảm là 0,8 mol nên : n Y = n x − 0 , 8 = 2 + 3 − 0 , 8 = 4 , 2 mol
Theo định luật bảo toàn khối lượng ta có : m Y = m x = m N 2 + m H 2 = 2 . 28 + 3 . 2 = 62 gam
Vậy M ¯ Y = m Y n Y = 62 4 , 2 = 14 , 76

nBr2 = 0,05
Dẫn hỗn hợp Y qua dung dịch Br2 dư thấy khối lượng bình tăng 1,82 gam và có 8 gam brom đã tham gia phản ứng
⇒ nAnken/Y = nBr2 = 0,05 = nC2H4 dư + nC3H6 dư (1)
mAnken/Y = 1,82g
Vì Hiệu suất hidro hóa của 2 anken như nhau
⇒ nC2H4 phản ứng : nC2H4 ban đầu = nC3H6 phản ứng : nC3H6 ban đầu
⇒ nC2H4 dư : nC2H4 = nC3H6 dư : nC3H6
⇒ nC2H4 dư : 0,1 = nC3H6 dư : 0,15 (2)
Từ (1) và (2) ⇒ nC2H4 dư = 0,02 ; nC3H6 = 0,03
nC2H4 phản ứng = 0,1 – 0,02 = 0,08
⇒ H = (0,08 : 0,1).100% = 80%
Đáp án B.

Đáp án D

Giả sử ban đầu có 40 mol khí, sau phản ứng sẽ có 31 mol khí.
Sử dụng đường chéo, ta tính được
Do sau phản ứng vẫn thu được hỗn hợp khí nên H2 sẽ dư
Số mol H2 phản ứng: 40-31=9
Hiệu suất phản ứng: H=
9
16
=
56
,
25
%
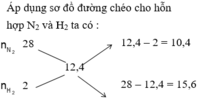
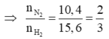



\(M_X=12,4\)
Áp dụng phương pháp đường chéo:
12,4 H 2 (2) N 2 (28) 10,4 15,6
\(\frac{n_{N2}}{n_{H2}}=\frac{2}{3}\)
Có 2 mol N2 và 3 mol H2
\(n_{N2\left(tt\right)}=2.40\%=0,8\left(mol\right)\)
\(n_{H2\left(tt\right)}=3.40\%=1,2\left(mol\right)\)
\(PTHH:N_2+3H_2\rightarrow2NH_3\)
Ban đầu__0,8___1,2________
Phứng___0,4____1,2________
Sau_____0,4____0________0,8
\(\Rightarrow\overline{M_Y}=\frac{28.0,4+0,8.17}{1,2}=20,67\)