Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

![]() Hỗn hợp anken hết trước, hiệu suất tính theo anken
Hỗn hợp anken hết trước, hiệu suất tính theo anken
Ta có: ![]() (vì n = pV/RT suy ra n tỉ lệ thuận với p)
(vì n = pV/RT suy ra n tỉ lệ thuận với p)
(trong đó n1, p1 là số mol và áp suất hỗn hợp lúc đầu, n2, p2 là số mol, áp suất hỗn hợp lúc sau)
![]()
Số mol hỗn hợp sau:
![]()
Số mol khí giảm
![]()
Vậy hiệu suất ![]()
Đáp án B.

Đáp án A
gọi số mol eten, propen, hiđro trong hỗn hợp X lần lượt 2x, 3x, y.
Ta có hệ:
2x + 3x + y = 0,5 mol
và khối lượng: 28 × 2x + 42 × 3x + 2y = 3,94 × 4 × 0,5.
Giải hệ có nghiệm x = 0,04 mol và y = 0,3 mol.
X
→
t
o
Y nên mY = mX = 7,88 gam.
lại có dY/H2 = 12,3125 nên nY = 0,32 gam.
chú ý X
→
t
o
Y, số mol Y giảm (0,5 - 0,32 = 0,18 mol) so với X là do H2 mất đi
khi đi vào nối đôi C=C của anken (hay hiểu đơn giản: 1π làm mất 1H2).
→ nH2 = nX - nY = 0,18 mol.
Gọi hiệu suất hiđro hóa của 2 anken đều là h, ta có:
nanken phản ứng = nH2 phản ứng ↔ 0,2h = 0,18 → h = 0,9.
Nghĩa là, sau phản ứng lượng anken còn lại để phản ứng tiếp với brom chỉ là 0,1 × 0,08 = 0,008 mol eten và 0,012 mol propen.
Khối lượng bình brom tăng chính là khối lượng của anken: m = 0,008 × 28 + 0,012 × 42 = 0,728 gam.
Đáp án đúng cần chọn là A

Đáp án D
► Giả sử có 1 mol X. Đặt nH2 = x; nC3H6 = y ⇒ nX = x + y = 1 mol.
mX = 2x + 42y = 1 × 5,5 × 4 ||⇒ giải hệ có: x = y = 0,5 mol.
● Bảo toàn khối lượng: mY = mX = 22(g) ⇒ nY = 22 ÷ 27,5 = 0,8 mol.
||⇒ nCH6 phản ứng = ∆n = nX – nY = 0,2 mol ||► H = 0,2 ÷ 0,5 × 100% = 40%

1)Hỗn hợp khí A : CnH2n (b mol ) và H2 ( a mol )
d A/H2 = 9,1 => MA/MH2 = 9,1 (1)
Không làm mất màu Brom đó là Ankan
CnH2n + H2 -(Ni , t°)-> CnH2n+2
b ---------> b ----------> b (mol)
Hỗn hợp khí B là : CnH2n+2 ( b mol ) và H2 dư ( a - b ) (mol)
d B/H2 = 13 => MB/MH2 = 13 (2)
Từ (1) , (2) => MA / 9,1 = MB / 13
<=> mA / nA.9,1 = mB / nA.13
Mà định luật bảo toàn khối lượng : mA = mB
<=> nA.9,1 = nB.13
<=> (a + b).9,1 = (a - b + b ).13
<=> 9,1a + 9,1b = 13a
<=> 9,1b = 3,9a
<=> a = 7/3b
Mà MA = (14n.b + 2a) / a + b = 9,1 x 2 = 18,2
<=> 14nb + 14/3b / 7/3b + b = 18,2
<=> 14b(n + 1/3) / 10/3b = 18,2
<=> 21/5(n + 1/3) = 18,2
<=> n + 1/3 = 13/3
<=> n = 4
=> Đó là C4H8
Mà khả năng cộng với HBr ra 1 sản phẩm duy nhất.
CH3 - CH = CH - CH3
3 sd PP đường chéo => n H2 : n C2H4 = 1:1,
coi n H2 = n C2H4 = 1 mol
g/s sau P.ư tọa ra a mol C2H6
=> n H2 = n C2H2 = 1-a
khối lượng TB M=m/n=20 giải ra => a=0,5
=> H=50%

nBr2 = 0,05
Dẫn hỗn hợp Y qua dung dịch Br2 dư thấy khối lượng bình tăng 1,82 gam và có 8 gam brom đã tham gia phản ứng
⇒ nAnken/Y = nBr2 = 0,05 = nC2H4 dư + nC3H6 dư (1)
mAnken/Y = 1,82g
Vì Hiệu suất hidro hóa của 2 anken như nhau
⇒ nC2H4 phản ứng : nC2H4 ban đầu = nC3H6 phản ứng : nC3H6 ban đầu
⇒ nC2H4 dư : nC2H4 = nC3H6 dư : nC3H6
⇒ nC2H4 dư : 0,1 = nC3H6 dư : 0,15 (2)
Từ (1) và (2) ⇒ nC2H4 dư = 0,02 ; nC3H6 = 0,03
nC2H4 phản ứng = 0,1 – 0,02 = 0,08
⇒ H = (0,08 : 0,1).100% = 80%
Đáp án B.

Đáp án A
Sơ đồ ta có:

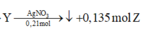
( Z phản ứng với 0,165 mol Br2)
Có
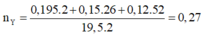
nH2phản ứng = nX- nY = 0,195 mol
+ Chất tham gia phản ứng với AgNO3/NH3 lần lượt là C2H2 dư : amol, C4H4 : b mol và CH≡C-CH2-CH3: c mol
Có 2a + b + c = 0,21
nY=a +b +c + nZ → a+b +c =0,135
+ Bảo toàn liên kết π → 2a + 3b + 2c = ( 0,15.2+ 0,12. 3) - 0,195 - 0,165
+ Giải hệ → a = 0,075; b = 0,03 và c = 0,03
m↓ =0,075. 240 + 0,03. 159 + 0,03, 161 = 27,6 gam.