Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khi cho hỗn hợp A qua dung dịch brom dư, có phản ứng :
C 2 H 2 + 2 Br 2 → C 2 H 2 Br 4
Vì phản ứng xảy ra hoàn toàn và có hai khí thoát ra khỏi dung dịch brom, nên hai khí đó là CH 4 và C n H 2 n + 2
Theo đề bài V C 2 H 2 tham gia phản ứng là : 0,896 - 0,448 = 0,448 (lít).
Vậy số mol C 2 H 2 là 0,448/22,4 = 0,02 mol
Gọi số mol của CH 4 là X. Theo bài => số mol của C n H 2 n + 2 cũng là x.
Vậy ta có : x + x = 0,448/22,4 = 0,02 => x = 0,01
Phương trình hoá học của phản ứng đốt cháy hỗn hợp :
2 C 2 H 2 + 5 O 2 → 4 CO 2 + 2 H 2 O
CH 4 + 2 O 2 → CO 2 + 2 H 2 O
2 C n H 2 n + 2 + (3n+1) O 2 → 2n CO 2 + 2(n+1) H 2 O
Vậy ta có : n CO 2 = 0,04 + 0,01 + 0,01n = 3,08/44 => n = 2
Công thức phân tử của hiđrocacbon X là C 2 H 6

Tính % thể tích các khí :
% V C 2 H 2 = 0,448/0,896 x 100% = 50%
% V CH 4 = % V C 2 H 6 = 25%

Thể tích khí đã tác dụng với dung dịch brom là : 6,72 - 2,24 = 4,48 (lít).
=> Số mol khí phản ứng với dung dịch brom là : 4,48/22,4 = 0,2 mol
Khối lượng bình brom tăng lên là do khối lượng hiđrocacbon bị hấp thụ. Vậy khối lượng mol phân tử của hiđrocacbon là :
5,6/0,2 = 28 (gam/mol)
=> Công thức phân tử của một hiđrocacbon là C 2 H 4
Dựa vào phản ứng đốt cháy tìm được hiđrocacbon còn lại là CH 4
% V C 2 H 4 = 4,48/6,72 x 100% = 66,67%; V CH 4 = 33,33%

Vì bài toán chỉ có số liệu tương đối (%) nên để đơn giản và không mất tính tổng quát, ta có thể chọn số mol một chất bất kì. Ta chọn nX = 1(mol)
![]()
Khi làm lạnh thì hơi nước ngưng tụ vậy Y chỉ chứa CO2 và O2 dư.
Pt:
CxHy + (x + 0,25y)O2 → xCO2 + 0,5yH2O
a → a(x + 0,25y) ax 0,5ay
dư: 1 – a – a(x + 0,25y)

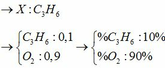

Đặt số mol CH4, C3H6, C2H2 trong m gam A là a, b, c mol
CH4 + 2O2 → CO2 + 2H2O
a 2a 2a
C3H6 + 4,5O2 → 3CO2 + 3H2O
b 4,5b 3b
C2H2 + 2,5O2 → 2CO2 + H2O
c 2,5c c
nO2 = 2a + 4,5b + 2,5c = 0,575 mol (1)
nH2O = 2a + 3b + c = 0,35 mol (2)
Đặt số mol CH4, C3H6, C2H2 trong 4,48 lít A là k.a, k.b, k.c mol
(hai phần có lượng khác nhau nhưng tỉ lệ giữa các chất trong hỗn hợp không đổi)
nA = ka + kb + kc = 0,2 mol
nBr2 = kb + 2kc = 0,25 mol
Lấy hai vế của phương trình chia cho nhau để triệt tiêu k
→ \(\dfrac{a +b+c}{b+2c}=\dfrac{0,2}{0,25}\) (3)
Từ (1), (2), (3)
→ a = 0,05, b = 0,05, c = 0,1

nBr2 = 0,125 mol
Khi đốt cháy nA = 0,25 mol
mNaOH ban đầu = 36g => nNaOH = 0,9 mol
Gọi x, y lần lượt là số mol của CO2 và H2O
mdd = 180 + 44x + 18y
Vì NaOH dư do đó chỉ tạo muối trung hòa
CO2 +2NaOH → Na2CO3 + H2O
x 2x
nNaOH dư = 0,9 – 2x
có 2 , 75 % = 40 ( 0 , 9 - 2 x ) 180 + 44 x + 18 y . 100 % (1)
=> 81,21x + 0,495y = 31,05n
2,8 lít khí A tác dụng với 0,125 mol Br2
=> 5,6 lít khí A tác dụng với 0,25 mol Br2
Gọi số mol khí của CH4, C2H4 và C2H2 lần lượt là a; b; c
Ta có a + b + c = 0,25 mol
Và b + 2c = 0,25
=> a = c
=> khi đốt cháy hỗn hợp A cho nCO2 = nH2O
Thay vào (1) => x = y = 0,38 mol
Bảo toàn C, H khi đốt cháy ta có
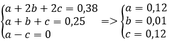
=> %VCH4 = %VC2H2 = 48%
%VC2H4 = 4%

a)
\(n_{CH_4}=n_{C_xH_y}=\dfrac{0,5}{22,4}\left(mol\right)\)
=> \(\dfrac{0,5}{22,4}.16+\dfrac{0,5}{22,4}.M_{C_xH_y}=0,9375\)
=> MCxHy = 26 (g/mol)
=> x = 2, y = 2 thỏa mãn
CTPT: C2H2
b)
\(n_{C_2H_2}=\dfrac{\dfrac{8,96}{2}}{22,4}=0,2\left(mol\right)\)
x = mtăng = mC2H2 = 0,2.26 = 5,2 (g)
PTHH: C2H2 + 2Br2 --> C2H2Br4
0,2----->0,4
=> nBr2(tt) = \(\dfrac{0,4.120}{100}=0,48\left(mol\right)\)
=> \(V_{dd.Br_2}=\dfrac{0,48}{2}=0,24\left(l\right)\)
c) \(n_{CH_4}=n_{C_2H_2}=0,2\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,2--->0,4
=> VO2 = 0,4.22,4 = 8,96 (l)
=> Vkk = 8,96 : 20% = 44,8 (l)