Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

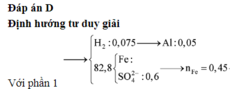
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18.
Đáp án D

Giải thích:
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH Giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)
Đáp án D

Đáp án D
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2 => X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol) => nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)

Đáp án D
Các phản ứng xảy ra hoàn toàn, hỗn hợp rắn X tác dụng với NaOH giải phóng khí H2
=> X chứa A dư, oxit sắt bị khử hết
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
0,02 ← 0,03 (mol)
nAl(OH)3 = 46,8 : 78 = 0,6 (mol)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
0,29 ← ( 0,6 – 0,02)
Z gồm Fe, xét quá trình Z tan trong HNO3
nNO = 0,58 (mol)
=> nNO3- ( trong muối) = 3nNO = 3.0,58 =1,74 (mol)
=> mFe = 146,52 – 1,74.62 = 38,64(g)
=> mOXIT SẮT = mFe + mO = 38,64 + 0,29.3.16 = 52,56 (g)

Giải thích:
Phần 1:
nH2 = 0,075 => nAldư = 0,05
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
8x→ 3x →4x → 9x
Chất rắn không tan trong NaOH là Fe (9x mol). Với H2SO4 đặc nóng
=> Fe3+ (u) và Fe2+ (v)
Bảo toàn electron: 3u + 2v = 0,6 . 2
m muối = 400a/2 + 152b = 82,8
=> u = 0,3 và v = 0,15
=> 9x = u + v => x = 0,05
Vậy phần 1 chứa Al (0,05), Al2O3 (0,2) và Fe (0,45)
=> mPhần 1 = 46,95
=> mPhần 2 = mX - mPhần 1 = 187,8
=> mPhần 2 = 4mPhần 1
Vậy phần 2 chứa các chất có số mol gấp 4 phần 1.
Phần 2 chứa Al (0,2), Al2O3 (0,8) và Fe (1,8)
=> nO = 0,8 . 3 = 2,4
nH+ = 12,97 = 4nNO + 2nNO2 + 2nO + 10nNH4+
=> nNH4+ = 0,015
Dung dịch A chứa Fe3+ (a mol), Fe2+ (y mol) và các ion khác.
Bảo toàn Fe => a + b = 1,8
Bảo toàn electron => 3a + 2b + 0,2 . 3 = 1,25 . 3 + 1,51 + 0,015 . 8
=> a = 1,18 và b = 0,62
Đáp án D
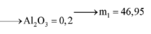
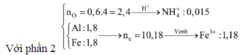
Ta có:
\(n_{NO}=0,55\left(mol\right)\)
Gọi \(n_{Cu}:a\left(mol\right)\Rightarrow n_{Al}:3a\left(mol\right)\)
PTHH:
\(Cu^o\rightarrow Cu^{2+}+2e\)
\(Al^o\rightarrow Al^{3+}+3e\)
\(n_{electron\left(cho\right)}=11a\left(mol\right)\)
\(N^{5+}\rightarrow N^2+3e\)
\(n_{electrong.nhan}=0,55.3=1,65\left(mol\right)\)
BT e:
\(n_{e\left(cho\right)}=n_{e\left(nhan\right)}\Rightarrow11a=1,65\Rightarrow a=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Cu}=0,15\left(mol\right)\\n_{Al}=0,45\left(mol\right)\end{matrix}\right.\)
\(m=0,15.64+0,45.27=21,75\left(g\right)\)
\(4H^++NHO_3^-\rightarrow NO+2H_2O+3e\)
\(\Rightarrow n_{HNO3}=0,55.4=2,2\left(mol\right)\)
\(\Rightarrow V_{HNO3}=\frac{2,2}{1}=2,2\left(l\right)\)