Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_M=\frac{0,8}{M_M}\left(mol\right)\)
\(n_{H_2SO_4}=0,5.0,1=0,05\left(mol\right)\)
\(n_{NaOH}=0,0334.1=0,0334\left(mol\right)\)
PTHH: \(M+H_2SO_4\rightarrow MSO_4+H_2\)
______\(\frac{0,8}{M_M}\)--->\(\frac{0,8}{M_M}\)_____________________(mol)
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,0334----->0,0167_______________________(mol)
=> \(\frac{0,8}{M_M}+0,0167=0,05\) => MM = 24(g/mol)
=> M là Mg

Đáp án: A.
Phương trình hóa học:
![]()
Số mol khí
N
O
2
: 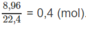
Theo phương trình hoá học :
n M = 0,2 mol và
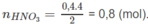
Khối lượng mol nguyên tử của kim loại M :
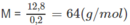
⇒ kim loại là Cu (đồng).
Gọi V (ml) là thể tích của dung dịch H N O 3 60,0%. Ta có phương trình liên hệ V với n H N O 3 :
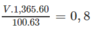
⇒ V = 61,5 ml

M2On→ MCln →M(OH)n
nO/X =(105-50) /55 = 1 (mol)
Tiếp tục tăng giảm khối lượng 1Cl → 1OH
Mỗi mol Cl hoán đổi như vậy thì khối lượng giảm 18,5 gam
→ m↓ =105 – 18,5.2 = 68 gam
Chọn đáp án B

Chọn đáp án B
Do tác dụng được với Ag2O/NH3 tạo kết tủa nên chắc chắn có HCOOH.
nAg = 0,2 ⇒ nHCOOH = 0,1 ⇒ mHCOOH = 4,6 gam.
mRCOOH = 13,4 – 8,8 gam.
nRCOOH = 0,2 – 0,1 = 0,1 mol ⇒ MRCOOH = 88
⇒ C3H7COOH ⇒ Chọn B
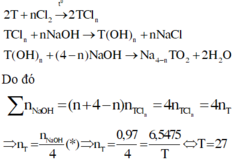
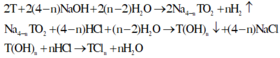
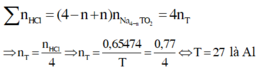

Số mol H 2 S O 4 trong 100ml dung dịch 0,5M là :
Số mol NaOH trong 33,4 ml nồng độ 1M :
H 2 S O 4 + 2NaOH → N a 2 S O 4 + 2 H 2 O
Lượng H 2 S O 4 đã phản ứng với NaOH :
Số mol H 2 S O 4 đã phản ứng với kim loại là :
5. 10 - 2 - 1.67. 10 - 2 = 3,33. 10 - 2 mol
Dung dịch H 2 S O 4 0,5M là dung dịch loãng nên :
X + H 2 S O 4 → X S O 4 + H 2 ↑
Số mol X và số mol H 2 S O 4 phản ứng bằng nhau, nên :
3,33. 10 - 2 mol X có khối lượng 0,8 g
1 mol X có khối lượng: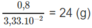
⇒ Mkim loại = 24 g/mol.
Vậy kim loại hoá trị II là magie.