Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nK=0,5(mol)
PTHH: K + H2O -> KOH + 1/2 H2
nKOH=nK=0,5(mol) => mKOH=0,5. 56=28(g)
mddKOH=mK+mH2O-mH2=19,5+ 261- 0,25 x 2= 280(g)
=>C%ddKOH=(28/280).100=10%

\(a.\)
\(m_{dd}=10+40=50\left(g\right)\)
\(C\%=\dfrac{10}{50}\cdot100\%=20\%\)
\(b.\)
\(m_{KOH}=0.25\cdot56=14\left(g\right)\)
\(m_{dd_{KOH}}=14+36=50\left(g\right)\)
\(C\%_{KOH}=\dfrac{14}{50}\cdot100\%=28\%\)

Gọi a là KL CaO đã hoà tan thành dung dịch (a>0) (gam)
\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\\ Ta.được.dung.dịch.nước.vôi.trong.nồng.độ.là.0,2\%\\ \Rightarrow\dfrac{\dfrac{74}{56}a}{a+96\%.200}.100\%=0,2\%\\ \Leftrightarrow a\approx0,291\left(g\right)\)
\(\Rightarrow\%m_{\dfrac{CaO\left(tan\right)}{CaO\left(bđ\right)}}\approx\dfrac{0,291}{7}.100\approx4,16\%\)

Bài 13: nNa= 0,2 mol ; nK= 0,1 mol
2Na + 2H2O → 2NaOH + H2↑
0,2 mol 0,2 mol 0,1 mol
2K + 2H2O → 2KOH + H2↑
0,1 mol 0,1 mol 0,05 mol
a) tổng số mol khí H2 là: nH2= 0,1 + 0,05 = 0,15 mol
→VH2= 0,15 x 22,4 = 3,36 (l)
b) mNaOH= 0,2 x 40= 8 (g) ; mKOH= 0,1 x 56= 5,6 (g)
mdung dịch= mNa + mK + mH2O - mH2 = 4,6 + 3,9 + 91,5 - 0,15x2 = 99,7 (g)
→C%NaOH= 8/99,7 x100%= 8,02%
→C%KOH= 5,6/99,7 x100%= 5,62%

a,b. \(PTHH:2K+2H_2O\rightarrow2KOH+H_2\)
.......................78..........36............92............2 (g)
......................19,5.......................23.................(g)
c. Nồng độ phần trăm của dung dịch thu được sau phản ứng:
\(C\%=\frac{23}{261}.100\approx8,81\left(\%\right)\)

5 Nồng độ phần trăm là gì? Trong hóa học, nồng độ phần trăm của dung dịch được kí hiệu là C% cho ta biết số gam chất tan có trong 100 gam dung dịch là bao nhiêu
C%=\(\dfrac{20}{620}.100=3,22\%\)
CM=\(\dfrac{1,5}{0,75}\)=2M
6 ko giải thích lại
C%=\(\dfrac{30}{230}100=13\%\)
CM=\(\dfrac{1}{0,2}\)=5M

PTHH: \(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\uparrow\)
a) Ta có: \(n_K=\dfrac{7,8}{39}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{KOH}=0,2\left(mol\right)\\n_{H_2}=0,1\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{KOH}=0,2\cdot56=11,2\left(g\right)\\m_{H_2}=0,1\cdot2=0,2 \left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd\left(saup/ứ\right)}=m_K+m_{H_2O}-m_{H_2}=400\left(g\right)\)
\(\Rightarrow C\%_{KOH}=\dfrac{11,2}{400}\cdot100\%=2,8\%\)
b) Ta có: \(V_{dd\left(saup/ứ\right)}=\dfrac{400}{1,08}\approx370,37\left(ml\right)=0,37037\left(l\right)\)
\(\Rightarrow C_{M_{KOH}}=\dfrac{0,2}{0,37037}\approx0,54\left(M\right)\)
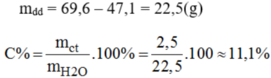
nK = \(\dfrac{19,5}{39}\) = 0,5 mol
2K + 2H2O -> 2KOH + H2
0,5 ->0,5 ->0,25
=>C% = \(\dfrac{0,5.56}{19,5+261-0,25.2}\).100% = 10%
\(C\%=m_{ct}:m_{dd}.100\%=19,5:261.100\%=7,4\%\)