Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Fe + 2HCl →FeCl2 + H2 CuO + H2 →Cu +H2O
n hcl = 0.2 →nh2 = 0.1→Vh2 =2.24 lit
nCuO =0.1 →nCu =0.1 →mCu=6.4 g

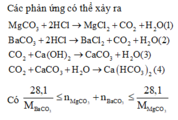
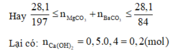
nCa(OH) =0,5.0,4 = 0,2(mol)
Nhận thấy: Lượng kết tủa thu được là lớn nhất khi chỉ xảy ra phản ứng (3) mà không có phản ứng (4) và lượng CO2 phản ứng vừa đủ với lượng Ca(OH)2 trong dung dịch.
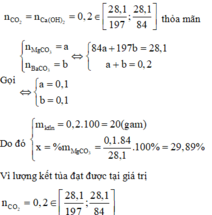
Nên hiện tượng quan sát được khi cho lượng CO2 thay đổi trong đoạn giá trị trên là: Lượng kết tủa tăng dần cho đến giá trị cực đại sau đó lượng kết tủa bị lượng CO2 dư sau phản ứng (3) hòa tan dần.
Do đó lượng kết tủa nhỏ nhất thu được ở 1 trong 2 trường hợp sau:
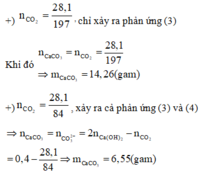
So sánh hai trường hợp ta có khối lượng kết tủa thu được nhỏ nhất là 6,55 gam khi hỗn hợp chỉ gồm MgCO3 hay x= 100.
Đáp án A

- Gọi số mol Al, Ca và Al(OH)3 là x, y, z ( mol )
\(PTKL:27x+40y=4,55\left(g\right)\)
- Thấy trong dung dịch Y có : Ca2+ y mol, AlO2- x, có thể có OH- ( 2y - x ) mol .
- Khi cho HCl vào dung dịch Y, HCl sẽ trung hòa lượng OH- dư và tạo kết tủa với 0,15mol và tạo kết tủa cực đại và hòa tan 1 phần với 0,19mol .
\(\Rightarrow\left\{{}\begin{matrix}0,15=2y-x+z\\0,19=2y-x+x+3\left(x-z\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}-x+2y+z=0,15\\3x+2y-3z=0,19\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}x=0,05\\y=0,08\\z=0,04\end{matrix}\right.\) ( mol )
=> \(\%Al=29,67\%\left(D\right)\)

Đáp án C
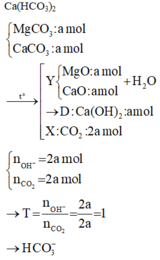
Ta có sơ đồ phản ứng:
m(gam) (Mg, Fe) + --O2→ (m+4,16) gam B + --HCl→ D (Mg2+ x mol; Fe2+ y mol; Fe3+ z mol); Cl-)
D + --AgNO3→ (11m – 12,58) gam (Ag + AgCl)
Ta có m(O) = 4,16 gam → n(O) = 0,26 mol → n(Cl- trong D) = 0,52 mol
→ n(AgCl) = 0,52 mol
Ta có hệ phương trình
(1): 24x + 56(y+z) = m
(2) ĐLBT điện tích: 2x+2y+ 3z = 0,52
(3) m + 0,52*35,5 = 4m-6,5
→ m = 8,32 gam → n(Ag) = 0,04 = y → x = 0,16; z = 0,04
Mặt khác trong 4,5m gam A có: Mg = 0,72 mol và Fe 0,36 mol
Dung dịch muối: Mg2+: 0,72 mol; Fe3+: 0,36mol; NH4+: t mol; NO3-: q mol
hợp khí F gồm N2 (0,04 mol) và N2O (0,04 mol)
Áp dụng ĐLBT mol e: → t = 0,225 mol
Áp dụng ĐLBT điện tích → q = 2,745 mol → m 211,68 gam
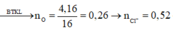
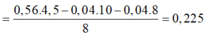
coi hỗn hợp chỉ có MgCO3 thì nB=nCO2=nMgCO3=9,24/84=0,11
coi hỗn hợp chỉ có CaCO3 thì nB=nCO2=nCaCO3=9,24/100=0,0924
suy ra 0,0924<nCO2<0,11
nBa(OH)2=nBaO=0,1
TH1 0,0924<nCO2<=0,1 thì nBaCO3=nCO2
suy ra m kết tủa = nCO2.197
TH2 0,1<nCO2<0,011
dựa vào 2 pt sau để tính nhe
Ba(OH)2 + CO2 ---> BaCO3 +H2O
Ba(OH)2 + 2CO2 --->Ba(HCO3)2