Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử NaOH phản ứng đủ ⇒ nNaNO3 = nNaOH = 0,4 mol
⇒ rắn chứa 0,4 mol NaNO2 ⇒ mNaNO2 = 0,4 × 69 = 27,6(g) > 26,44(g).
⇒ vô lí ⇒ NaOH dư
Giải hệ có 0,04 mol NaOH và 0,36 mol NaNO2.
nCu2+ = nCu = 0,16 mol; nNO3–/A = 0,36 mol. Bảo toàn điện tích:
nH+ dư = 0,36 - 0,16 × 2 = 0,04 mol ⇒ nH+ phản ứng = 0,2 × 3 - 0,04 = 0,56 mol.
⇒ nHNO3 phản ứng = 0,56 mol
Đáp án D

⇒ Số mol Cu = 0,12 mol
+) Dựa vào "Hòa tan hết 10,24 gam Cu" + "Số mol HNO3 đã phản ứng với Cu" ⇒ dd X có HNO3 dư.
+) NaOH cho vào X thì tác dụng lần lượt HNO3 dư và Cu(NO3)2.
+) Hiển nhiên HNO3 hết và NaOH tiếp tục phản ứng với Cu(NO3)2.
+) Nếu Cu(NO3)2 dư thì cô cạn dung dịch thu được Cu(NO3)2 là chất rắn ⇒ nung lên thu được 26,44 g CuO ⇒ nCu = nCuO = 0,3305 > 0,12.
⇒ NaOH dư.
⇒ Cô cạn dung dịch được NaOH, NaNO3 đem nung thu được 22,64 g NaOH, NaNO2 là chất rắn.
Đặt ẩn ra cho số mol NaOH = x và số mol NaNO2 = y ⇒ 40x + 69y = 26,44
Bảo toàn nguyên tố Na ban đầu thì x + y = 0,4
⇒ x = 0,04; y = 0,36 mol
⇒ nHNO3 dư = 0,36 – 0,32 = 0,04 mol
⇒ nHNO3 pứ với Cu = 0,6 – 0,04 = 0,56 mol
Đề này 26,44 mới đúng bạn ơi; 23,44 số lẻ .
Ta có:
\(n_{Cu}=\frac{10,24}{64}=0,16\left(mol\right)\)
\(n_{HNO3}=0,2.3=0,6\left(mol\right)\)
\(n_{NaOH}=0,4.1=0,4\left(mol\right)\)
Dung dịch A chứa Cu(NO3)2 và HNO3 có thể dư.
Khi cho NaOH vào có 2 trường hợp xảy ra.
TH1: NaOH hết cô cạn dung dịch thu được rắn chỉ chứa NaNO3
\(\Rightarrow n_{NaNO3}=n_{NaOH}=0,4\left(mol\right)\)
Nung rắn:
\(2NaNO_3\rightarrow2NaNO_2+O_2\)
\(\Rightarrow n_{NaNO2}=n_{NaNO3}=0,4\left(mol\right)\)
\(\Rightarrow m_{NaNO2}=0,4.69=27,6>26,44\) (loại)
TH2: NaOH dư.
Cô cạn dung dịch thu được NaNO3 x mol và NaOH dư y mol.
Nung rắn thu được NaNO2 x mol và NaOH dư y mol.
\(\Rightarrow\left\{{}\begin{matrix}x+y=0,4\\69x+40y=26,44\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,36\\y=0,04\end{matrix}\right.\)
\(\Rightarrow n_{N\left(trong.khí\right)}=0,6-0,36=0,24\left(mol\right)\)
Bảo toàn N:
\(n_{HNO3\left(pư\right)}=n_{N\left(trong.khi\right)}+2n_{Cu\left(NO3\right)2}=0,16.2+0,240,56\left(mol\right)\)

Đáp án B
Giả sử KOH không dư ⇒ nKNO2 = nKOH = 0,5 mol ⇒ mrắn ≥ mKNO2 = 42,5(g)
⇒ vô lí! ⇒ KOH dư. Đặt nKNO3 = x; nKOH dư = y. Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư ⇒ 85x + 56y = 41,05 ⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
Đặt nFe = a; nCu = b ⇒ mA = 56a + 64b = 11,6(g)
16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16
⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol. Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol. Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
⇒ Bảo toàn khối lượng: mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
-> nNO3–/X < 3nFe + 2nCu ⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol
⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%

Giả sử KOH không dư
⇒ nKNO2 = nKOH = 0,5 mol
⇒ mrắn ≥ mKNO2 = 42,5(g)
⇒ vô lí!. ⇒ KOH dư.
Đặt nKNO3 = x; nKOH dư = y.
Bảo toàn nguyên tố Kali: x + y = 0,5.
Rắn gồm KNO2 và KOH dư
⇒ 85x + 56y = 41,05
⇒ giải hệ có: x = 0,45 mol; y = 0,05 mol.
● Đặt nFe = a; nCu = b
⇒ mA = 56a + 64b = 11,6(g)
16(g) rắn gồm Fe2O3 và CuO.
⇒ 160.0,5a + 80b = 16
⇒ giải hệ có: a = 0,15 mol; b = 0,05 mol.
nHNO3 = 0,7 mol; nNO3–/X = nKNO3 = 0,45 mol.
Bảo toàn nguyên tố Nitơ: nN/B = 0,25 mol.
Bảo toàn nguyên tố Hidro: nH2O = 0,35 mol.
Bảo toàn nguyên tố Oxi: nO/B = 0,4 mol.
⇒ Bảo toàn khối lượng:
mX = 11,6 + 87,5 – 0,25 × 14 – 0,4 × 16 = 89,2(g).
► nNO3–/X < 3nFe + 2nCu
⇒ X gồm muối Fe(NO3)2, Fe(NO3)3 và Cu(NO3)2.
Giải hệ có: nFe(NO3)3 = 0,05 mol
⇒ C%Fe(NO3)3 = 0,05 × 242 ÷ 89,2 × 100% = 13,56%
Đáp án B

A. 184,1 gam và 91,8 gam.
B. 84,9 gam và 91,8 gam.
C. 184,1 gam và 177,9 gam.
D. 84,9 gam và 86,1 gam.

vì Fe dư nên dung dịch thu được chỉ có FeCl2,
FeCl2 +2AgNO3\(\rightarrow\)Fe(NO3)2 +2AgCl
X x 2x (mol)
Fe(N03)2 +AgNo3\(\rightarrow\)Fe(N03)3 +Ag
x x
\(143,5.2x+108x=39,5\Rightarrow x=0,1\)
bảo toàn nguyên tố Cl, ta có nHCl=nAgCl=0,2\(\rightarrow\)chọn B
k pt đúng k
vì Fe dư nên dung dịch thu được chỉ có FeCI2
FeCI2 + 2AgNO3 \(\rightarrow\) Fe(NO3)2 + 2AgCI
X x 2x (mol)
Fe(NO3)2 + AgNO3 Fe(NO3)3 + Ag
x x
\(143,5.2x+108x+39,5\) \(\Rightarrow\) \(x=0,1\)
Bảo toàn nguyên tố CI, ta có nHCI = nAgCI = 0,2 nên ta chọn B
Vậy đáp án là 1M



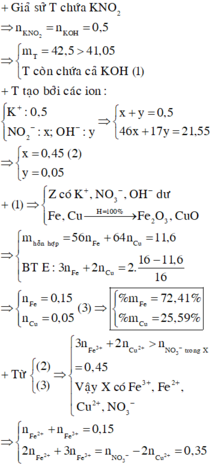
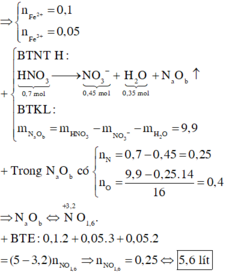
Giả sử toàn bộ Na → NaNO3 ⇒ nhiệt phân tạo thành NaNO2
⇒ mNaNO2 = 0,4 × 69 = 27,6 > 26,44 ⇒ Có NaOH dư.
+ Đặt nNaNO2 = a và nNaOHdư = b
⇒ Ta có hệ:
+ Nhận thấy nHNO3 = 0,6 mol nhưng nNO3– = 0,36 mol
⇒ nN bay ra theo khí = 0,6 – 0,36 = 0,24 mol.
+ Ta có nHNO3 pứ = nN/Cu(NO3)2 + nN bay ra theo khí = 2nCu + 0,24 = 0,56 mol
Đáp án A