Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) \(Fe+2HCl\rightarrow FeCl_2+H_2\)
b) \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
Theo PTHH: \(n_{HCl}=2n_{Fe}=0,4\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
c) Theo PTHH: \(n_{FeCl_2}=n_{H_2}=n_{Fe}=0,2\left(mol\right)\)
\(\Rightarrow m_{FeCl_2}=0,2.127=25,4\left(g\right)\)
d) \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
e) \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
PTHH: \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\Rightarrow CuO\) dư
Theo PTHH: \(n_{Cu}=n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,2.64=12,8\left(g\right)\)

a) Mg + 2HCl ---> H2 + MgCl2
0,25mol 0,25mol 0,25mol 0,25mol
b) + Số mol của HCl:
nHCl = m/M = 18,25/73 = 0,25 (mol)
+ Thể tích của khí H2:
VH2 = n.22,4 = 0,25.22,4 = 5,6 (l)
c) Khối lượng của MgCl2:
mMgCl2 = n.M = 0,25.95 = 23,75 (g)
P/S: 1. Phần in đậm là phần kê mol, sau khi tính mol rồi thì bạn mới kê vào
2. Bài mình giải là mình bỏ chỗ "có lấy dư 20%" đó nha, tại chỗ đó hơi khó hiểu với lại không liên quan đến cách giải thông thường, có gì không rõ nữa thì nhắn hỏi mình ha

a,\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,2 0,4 0,2
b, \(V_{H_2}=0,2.22,4=4,48\left(l\right)\)
c, \(m_{HCl}=0,4.36,5=14,6\left(g\right)\)

\(n_{Fe}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.2.......0.4....................0.2\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(m_{HCl}=0.4\cdot36.5=14.6\left(g\right)\)
PTHH : \(Fe+2HCl-->FeCl_2+H_2\uparrow\) (1)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
Từ (1) => \(n_{Fe}=n_{H_2}=0.2\left(mol\right)\)
=> \(V_{H2\left(đktc\right)}=n.22,4=0,2.22,4=4,48\left(l\right)\)
Từ (1) => \(2n_{Fe}=n_{HCl}=0.4\left(mol\right)\)
=> \(m_{HCl}=n.M=0,4.\left(1+35.5\right)=14.6\left(g\right)\)

Fe + 2HCl -> FeCl2 + H2
nFe = 5,6/56 = 0,1 mol
=>nH2 = 0,1 mol
=> VH2= 0,1*22,4= 2,24 lít
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
0,1-->0,2------------------>0,1
=> \(\left\{{}\begin{matrix}m_{ddHCl}=\dfrac{0,2.36,5}{15\%}=\dfrac{146}{3}\left(g\right)\\V_{H_2}=0,1.22,4=4,48\left(l\right)\end{matrix}\right.\)

Sửa đề thành 0,54 gam Al cho số mol đẹp bạn nhé!
PT: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Ta có: \(n_{Al}=\dfrac{0,54}{27}=0,02\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{H_2SO_4}=n_{H_2}=\dfrac{3}{2}n_{Al}=0,03\left(mol\right)\\n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,01\left(mol\right)\end{matrix}\right.\)
a, Ta có: \(n_{H_2}=0,03.22,4=0,672\left(l\right)\)
b, \(m_{H_2SO_4}=0,03.98=2,94\left(g\right)\)
c, \(m_{Al_2\left(SO_4\right)_3}=0,01.342=3,42\left(g\right)\)
Bạn tham khảo nhé!
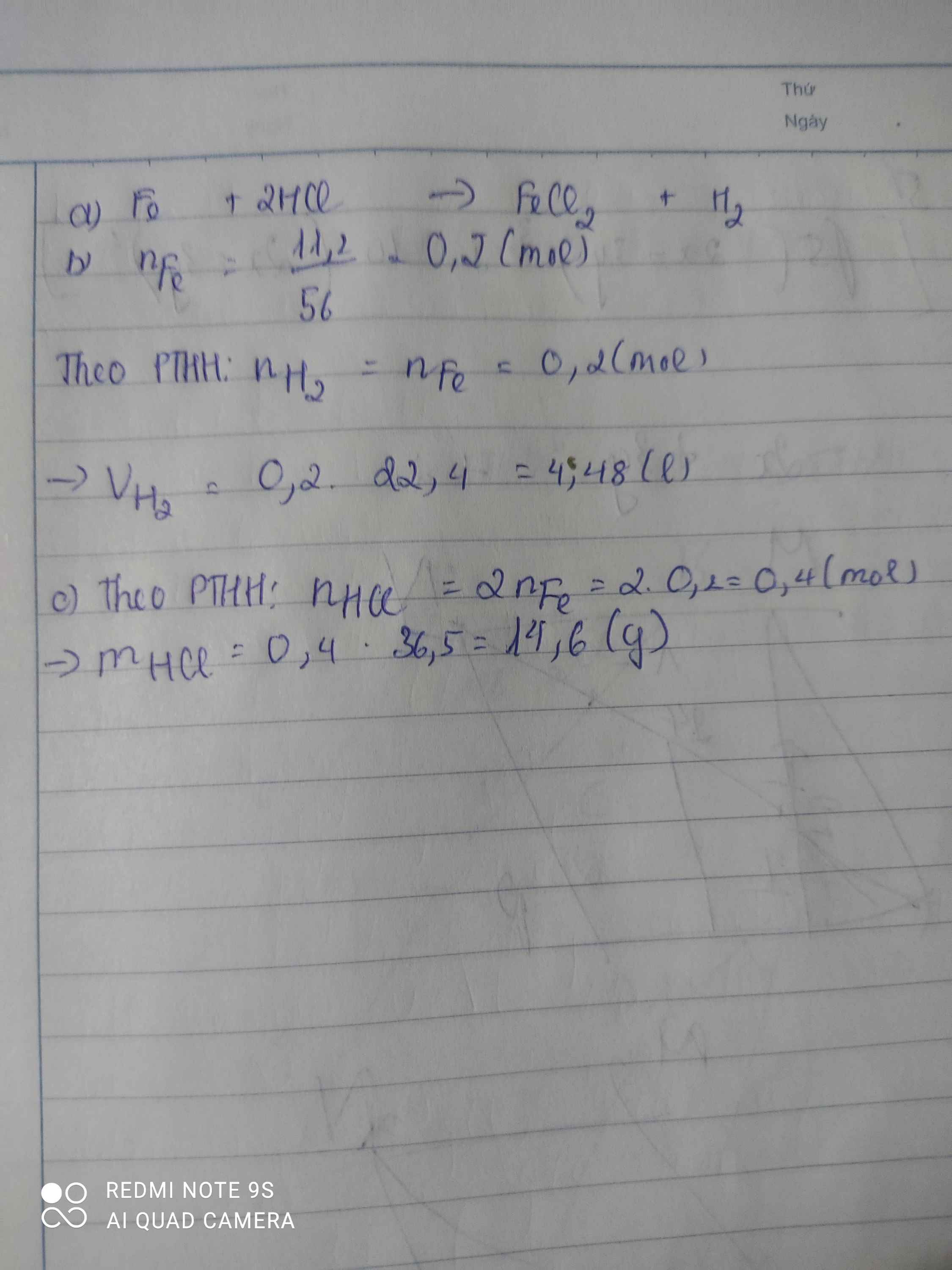
\(a) Fe + 2HCl \to FeCl_2 + H_2\\ b) n_{H_2} = n_{Fe} = \dfrac{8,4}{56} = 0,15(mol)\\ V_{H_2} = 0,15.22,4 = 3,36(lít)\\ n_{HCl} = 2n_{H_2} = 0,3(mol)\ m_{HCl} = 0,3.36,5 = 10,95(gam)\)
\(n_{Fe}=\dfrac{8.4}{56}=0.15\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(0.15......0.3..................0.15\)
\(m_{HCl}=0.3\cdot36.5=10.95\left(g\right)\)
\(V_{H_2}=0.15\cdot22.4=3.36\left(l\right)\)