Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi nFe3O4= a; nCu= b→ 232a+ 64b= 36 (1)
Fe3O4+ 8HCl→ 2FeCl3+ FeCl2+ H42O.
2FeCl3+ Cu→ 2FeCl2+ CuCl2.
Theo giả thiết: nCu dư= 6,4/64= 0,1(mol).
→ nCu PƯ= b–0,1
Từ 2 PT: nFe3O4= nFeCl3/2= nCu(PƯ)
↔ a= b–0,1 (2)
Giải hệ PT (1) và (2) ↔ a=0,1; b=0,2
Vậy %mFe3O4= 232.0,1.100/36 =64,44 (%)
Vì còn dư kim loại là Cu ==> thu được muối Fe2+
Gọi a, b là số mol Fe và Cu phản ứng , và x là số mol Cu dư
số mol HNO3 = 0,2*2 = 0,4
Fe - 2e --> Fe+2
a-----2a
Cu -2e --> Cu+2
b----2b
4H+ + NO3- + 3e --> NO + 2H2O
0,4--------------0,3
kim loại dư là Cu và số mol H2SO4 = 0,03333*2 ==> mol H+ = 0,1333
3Cu + 8H+ + NO3- --> 3Cu+2 + NO + H2O
0,05---0,133
Ta có : khối lượng kim loại phản ứng: 56a + 64b = 12 - 64*0,05 = 8,8
Bảo toàn số mol e : 2a+ 2b = 0,3
=> a = 0,1 và b = 0,05
===> = 5,6 g ==> câu A

đặt nồng độ mol của dd a là a , dd b la b. khi trộn 3 l a (có 3a mol) với 2 lit b (có 2b mol) được 5 lit dd x có dư axit. trung hoà 5 lit dd x cần
nKOH =0,2.5 = 1mol -> số mol H2SO4 dư: 0,5 mol.
H2SO4+ 2KOH -> K2SO4 +2 H2O
b-------------- 2b
số mol h2so4 dư = 3a – b = 0,5*
trộn 2l dd a (có 2a mol) với 3 lít ddb (có 3b mol) tạo 5 l dd y có koh dư. trung hoà 5 lit y cần 0,2 .5 = 1 mol hcl
pt: H2SO4 + 2KOH -> K2SO4 + 2H2O
2a---------------- 4a
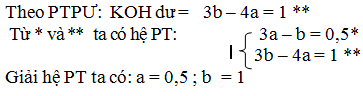

Goi nFe=x,nR=y.
56x+Ry=11,3.
X+y=0,3.
Tu 2 pt=>R<37,6.(1).
Thi ngiem 2.
=>nH2S04<0,4.
=>12<R.(2).
Tu 1 va 2=>
12<R<37,6.
R htri 2=>R la Mg.

số mol của hỗn hợp khí n= 0.2 mol.
AD Định luật bảo toàn khối lượng ta có.
n.CaC03 +n.CaS04 = m
n.BaC03 +n.Bas04 - a =m
=> nCaC03 +n.CaS04 = n.BaC03 +n.BaS04 - a
=> 47.2= 86-a
=> a=38.8.