Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2=0,6mol
PTHH: 2Al+6HCl=>2AlCl3+3H2
0,4<-1,2<--0,4 <- 0,6
=> mAl=0,4.27=10,8g
=> m AL2O3=21-10,8=10,2g
=> nAl2O3=0,1mol
PTHH: Al2O3+6HCl=> 2AlCl3+3H2O
0,1--->0,6------>0,2----->0,3
PTHH: AlCl3+3NaOH=> Al(OH)3+3NaCl
nAl(OH)3=0,4mol
nAlCl3=0,4+0,2=0,6mol
ta có : 0,6 : 0,4
=> n AlCl3 dư theo n nAl(OH)3
p/ư: 0,4<-1,2<------0,4--->1,2
=> V (NaOH) cần dùng là : V=1,2:0,5=2,4l

a) Vì A và B là 2 kim loại kiềm nằm kế tiếp nhau trong nhóm A nên đặt M là kim loại trung bình của A và B.
2M + 2H2O --> 2MOH + H2
VH2 = 2,24l nên nH2 = 0.1 mol. Suy ra nM= 2nH2 = 0.2 mol
Tính ra MM = 31 nên lựa chọn Na và K vì MNa = 23 < MM = 31 < MK = 39.
b) Theo PTPU ta có :
nNaOH = nKOH = 0.2 mol
mdd = mhh kim loại + mH2O – mH2 = 6.2 + 100 – 0.2 = 106 gam
C% NaOH = (0.2*40*100)/106 = 7.55%
C%KOH = 10.57%

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
a) Phương trình hóa học của phản ứng:
Zn + S \(\rightarrow\) ZnS
Fe + S \(\rightarrow\) FeS
ZnS + H2SO4 \(\rightarrow\) ZnSO4 + H2S
FeS + H2SO4 \(\rightarrow\)H2S + FeSO4
nZn = x mol.
nFe = y mol.
nH2S = 1,344 / 22,4 = 0,06 mol.
mhh = 65x + 56y = 3,27g.
nH2S = x + y = 0,06 mol.
Giải hệ phương trình trên ta được:
x = 0,04 mol, y = 0,02 mol.
mZn = 65 × 0,04 = 2,6g
mFe = 56 × 0,02 = 1,12g

Đáp án C
Số mol SO2 thu được là: n SO 2 = 0 , 2 mol
Gọi hóa trị của M là n
Số mol của M là : n M = 12 , 8 M mol
Sơ đồ phản ứng :
![]()
Các quá trình nhường, nhận electron :


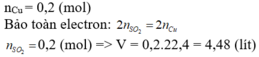
Chọn A
nCu = 12 , 8 64 = 0,2 (mol)
Bảo toàn electron: 2 n S O 2 = 2nCu
=> n S O 2 = nCu = 0,2 (mol) => V = 0,2.22,4 = 4,48 (lít)