Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol H 2 S O 4 trong 100ml dung dịch 0,5M là :
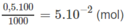
Số mol NaOH trong 33,4 ml nồng độ 1M :
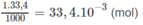
H 2 S O 4 + 2NaOH → N a 2 S O 4 + 2 H 2 O
Lượng H 2 S O 4 đã phản ứng với NaOH :

Số mol H 2 S O 4 đã phản ứng với kim loại là :
5. 10 - 2 - 1.67. 10 - 2 = 3,33. 10 - 2 mol
Dung dịch H 2 S O 4 0,5M là dung dịch loãng nên :
X + H 2 S O 4 → X S O 4 + H 2 ↑
Số mol X và số mol H 2 S O 4 phản ứng bằng nhau, nên :
3,33. 10 - 2 mol X có khối lượng 0,8 g
1 mol X có khối lượng: 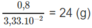
⇒ Mkim loại = 24 g/mol.
Vậy kim loại hoá trị II là magie.

- Xét phản ứng giữa OH- và H+:
pH = 13 > 7 → Bazo còn dư
→ pOH = 14 - 13 = 1 → [OH-] = 0,1 M
→ nOH- dư = 0,1.0,5 = 0,05 mol
nH+ = nHCl + nHNO3 = 0,04 + 0,06 = 0,1 mol
PT ion: H+ + OH- → H2O
Bđ:___0,1___x
Pư:___0,1___0,1
Sau:___0___x-0,1
→ nOH- dư = x - 0,1 = 0,05 → x = 0,15 mol
- Xét phản ứng của X với H2O dư:
2X + 2nH2O → 2X(OH)n + nH2 → nOH- = 2nH2
X2On + nH2O → 2X(OH)n → nOH- = 2nO
Vậy nOH- = 2nH2 + 2nO → 0,15 = 2.0,015 + 2.nO
→ nO = 0,06
→ mO = 0,06.16 = 0,96 gam
Do O chiếm 10% hỗn hợp → m = 9,6 gam

Đáp án A
nZn=0,66 mol => nZn(NO3)2=0,66 mol => mNH4NO3=129,54-0,66.189=4,8 gam => nNH4NO3=0,06 mol
G/s: NO: x mol; N2O=y mol
x+y=4,032/22,4=0,18
3x+2y.4+8.0,06=0,66.2 (BT e)
=> x=0,12; y=0,06
BTNT N: nHNO3=2nZn(NO3)2+nNO+2nN2O+2nNH4NO3=2.0,66+0,12+2.0,06+2.0,06=1,68 mol
V=mdd/d=[mHNO3.100/C]/d=(1,68.63.100/10)/1,26=840 ml

Đáp án: A.
Phương trình hóa học:
Số mol khí N O 2 :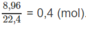
Theo phương trình hoá học :
n M = 0,2 mol và
Khối lượng mol nguyên tử của kim loại M :
⇒ kim loại là Cu (đồng).
Gọi V (ml) là thể tích của dung dịch H N O 3 60,0%. Ta có phương trình liên hệ V với n H N O 3 :
⇒ V = 61,5 ml