Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

= 39,985.
22,4 lít Ar ở đktc có khối lượng 39,985 g
x lít Ar ở đktc có khối lượng 10 g
=> x= 5,602 lít

Phương trình hóa học của phản ứng:
NaBr + AgNO3 \(\rightarrow\) AgBr + NaNO3
NaCl + AgNO3 AgCl + NaNO3
Gọi nNaBr =x, nNaCl = y.
Có nAgNO3 = 50 x 1,0625 x 8 /100 x 170 = 0,025 mol.
=> x + y = 0,025
Biết nồng độ phần trăm của mỗi muối trong dung dịch bằng nhau và khối lượng dưng dịch là 50g, do đó khối lượng NaCl bằng khối lượng NaBr.
=> 103x = 58,5y.
Giải hệ phương trình ta có x \(\approx\) 0,009 mol NaBr.
\(\Rightarrow\) mNaBr = mNaCl = 103 x 0,009 = 0,927g.
C% = 0,927 / 50 x 100% = 1,86%

\(n_{Ag}NO_3=\dfrac{0,15.85}{1000}=0,01275\left(mol\right)\)
Phương trình hoá học của phản ứng :
Cu + 2AgNO3 \(\rightarrow\) Cu(NO3)2 + 2Ag
1mol 2mol
x mol \(\leftarrow\) 0,01275 mol
x = 0,0127520,012752 = 0,006375 mol
mCu tham gia phản ứng : 0,006375 X 64 = 0,408 g.

nCaOCl2 = 254 / 127 = 2 mol.
Phương trình hóa học của phản ứng:
CaO + H2O \(\rightarrow\) Ca(OH)2
NaCl + H2SO4 \(\rightarrow\) NaHSO4 + HCl
MnO2 + 4HCl MnCl2 + Cl2 + 2H2O
Cl2 + Ca(OH)2 CaOCl2 + H2O
Khối lượng các chất:
mMnO2 = 87 x 2 = 174g.
nH2SO4 = 8 mol. mH2SO4 = 8 x 98 = 784g.
Vdd H2SO4 70% = 784 x 100 / 70 x 1,06 = 1056,60ml.
nNaCl = 8mol. \(\rightarrow\)mNaCl = 8 x 58,5 = 468g.
nCaO = 2 mol. \(\rightarrow\)mCaO = 2 x 56 = 112g.
B ơi cho mh hỏi là nacl + h2so4 á tại sao là nahso4 mà k phải là na2so4 b nhỉ? B có thể trả lời giúp mh đc k ?

a) Tổng số electron là 7, suy ra số thứ tự của nguyên tố là 7. Có 2 lớp electron suy ra nguyên tố ở chu kì 2. Nguyên tố p có 5 electron ở lớp ngoài cùng nên thuộc nhóm VA. Đó là ni tơ. Công thức phân tử hợp chất với hidro là NH3
b) Công thức electron và công thức cấu tạo của phân tử NH3
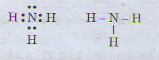

a) Nguyên tử photpho có 15e.
b) Số hiệu nguyên tử của p là : 15.
c) Lớp thứ 3 có mức năng lượng cao nhất.
d) p là phi kim vì có 5e ở lớp ngoài cùng.

a) Cấu hình electron của cation liti (Li+) là 1s2 và anion oxit (O2-) là 1s2s2p
b) Điện tích ở (Li+) do mất 1e mà có, điện tích ở (O2-) do nhận thêm 2e mà có
c) Nguyên tử khí hiếm He có cấu hình giống Li+
Nguyên tử khí hiếm Ne có cấu hình giống O2-
d) Vì mỗi nguyên tử liti chỉ có thể nhường 1e, mà một nguyên tử oxi thu được 2e.
2Li -> 2(Li+) + 2e;
O + 2e -> O2-
2Li+ + O2- -> Li2O
Gọi % đồng vị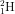 là a:
là a:
m của 1ml H2O: 1 gam
—> Khối lượng của 1 mol H20 là 18,016g.
Số nguyên tử H có trong 1ml H20
18,016
Số nguyên tử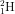 chiếm:
chiếm:  = 5,325.1020 nguyên tử.
= 5,325.1020 nguyên tử.
Gọi % đồng vị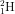 là a:
là a:
m của 1ml H2O: 1 gam
\(\rightarrow\) Khối lượng của 1 mol H20 là 18,016g.
Số nguyên tử H có trong 1ml H20
18,016
Số nguyên tử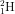 chiếm:
chiếm:  = 5,325.1020 nguyên tử.
= 5,325.1020 nguyên tử.