Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

phương trình a sai rồi kìa, nó có 2 chất cơ mà, sao ghi mỗi chất

a) Để chứng minh dung dịch H2SO4 loãng có những tính chất hóa học của axit, ta thực hiện các thí nghiệm:
Cho axit H2SO4 loãng lần lượt phản ứng với Fe, CuO, KOH:
Fe + H2SO4 → FeSO4 + H2 (có khí thoát ra)
(kim loại Cu không tác dụng với dd H2SO4 loãng)
CuO + H2SO4 → H2O + CuSO4 (dung dịch có màu xanh lam)
2KOH + H2SO4 → K2SO4 + H2O
(Cho quỳ tím vào dung dịch KOH, dung dịch có màu xanh. Rót từ từ dung dịch H2SO4 thấy màu xanh dần biến mất đến khi dung dịch không màu)
b) Để chứng minh dung dịch H2SO4 đặc có những tính chất hóa học riêng ta thực hiện các thí nghiệm:
Cho axit H2SO4 đặc tác dụng với Cu đun nóng và với glucozơ:
Cu + H2SO4 đ, nóng → CuSO4 + SO2 + H2O
(Đồng bị hòa tan dần, dung dịch chuyển sang màu xanh và có khí mùi hắc thoát ra)
C12H22O11 \(\underrightarrow{H_2SO_4}\) 12C + 11H2O
(Đường bị hóa thành than và đẩy lên khỏi cốc)
a) dung dịch H2SO4 loãng có những tính chất hóa học của axit
2KOH + H2SO4 ---> K2SO4 + 2H2O
Fe + H2SO4 ---> FeSO4 + H2\(\uparrow\)
CuO + H2SO4 ---> CuSO4 + H2O
b) dung dịch H2SO4 đặc ngoài những tính chất hóa học của axit còn có những tính chất hóa học riêng
Cu + 2H2SO4 --t0--> CuSO4 +SO2\(\uparrow\) +2H2O
C6H12O6 --H2SO4--> 6C + 6H2O

a) Có 2 chất : CH≡CH v à CH≡C-CH3 có liên kết 3
b) Có 3 chất làm mất màu dung dịch brom
CH≡CH , CH2=CH2 v à CH≡CH-CH3

Số mol CO2 = 2,24:22,4 = 0,1 mol
a) CO2 + Ba(OH)2 → BaCO3 + H2O
Phản ứng: 0,1 → 0,1 0,1
b) Số mol Ba(OH)2 có trong 200 ml dung dịch là 0,1 mol
CM Ba(OH)2 = 0,10,20,10,2 = 0,5 M
c) Chất kết tủa thu được sau phản ứng là BaCO3 có số mol là 0,1
m BaCO3 = 0,1 x 197 = 19,7 g
\(n_{CO_2}=\dfrac{2,24}{22,4}0,1\left(mol\right)\)
\(CO_2+Ba\left(OH\right)_2\rightarrow BaCO_3+H_2O\)
1 : 1 : 1 : 1
0,1 \(\rightarrow\)0,1 \(\rightarrow0,1\)
đổi 200ml=0,2l
\(C_M=\dfrac{0,1}{0,2}0,5\left(M\right)\)
ta có từ bảng trang 170,chất kết tủa là\(BaCO_3\)
\(\Rightarrow n_{BaCO_3}=o,1\left(mol\right)\)
\(\Rightarrow m_{BaCO_3}=0,1.196=19,6\left(g\right)\)

Phản ứng đốt cháy: CH4 + 2O2 —tº→ CO2 + 2H2O (1)
N2 và CO2 không cháy Khi được hấp thụ vào dung dịch,
Ca(OH)2 có phản ứng sau: Ca(OH)2 + CO2 —-> CaCO3↓+ H2O (2)
Thể tích CH4 là:
V/100 x 96 = 0,96 V
Thể tích CO2 là:
V/100 x 2 = 0,02 V
Theo phản ứng (1) thể tích CO2 tạo ra là 0,96V
Vậy thể tích CO2 thu được sau khi đốt là 0,96V + 0,02V = 0,98V
Số mol CO2 thu được là (0,98V : 22,4)
Theo (2) số mol CaCO3 tạo ra bằng số mol CO2 bị hấp thụ
=> nCO2 = 4,9 : 100 = 0,049 (mol)
Ta có phương trình: (0,98V : 22,4) = 0,049
=> V = (22,4 x 0,049) : 0,98 = 1,12 (lít)

Dung dịch bão hòa CO2 trong nước tạo ra dung dịch axit cacbonic (H2CO3) là axit yếu, có pH = 4.
CO2 + H2O ⇌ H2CO3.

Sắt tác dụng được với dung dịch Cu(N03)2 và khí Cl2.
Fe + Cu(NO3)2—> Fe(NO3)2 + Cu
2Fe + 3Cl2—> 2FeCl3

Khối lượng Fe có trong 1 tấn gang là: \(1.\dfrac{95}{100}=0,95\) tấn.
\(Fe_2O_3+3CO\rightarrow2Fe+3CO_2\)
| Tỉ lệ | 160 | 2.56 = 112 (tấn) |
| P.ư | m | 0,95 (tấn) |
Khối lượng Fe2O3, phản ứng: \(m=\dfrac{0,95.160}{2,56}=1,357\) (tấn)
Vì hiệu suất phản ứng chỉ đạt 80% nên khối lượng thực tế Fe2O3 cần là:
\(\dfrac{1,357.100}{80}=1,696\) (tấn)
Fe2O3 chỉ chiếm 60% khối lượng quặng hematit nên khối lượng quặng hematit cần là:
mquạng = \(\dfrac{1,696.100}{60}=2,827\) (tấn)

Phương trình hóa học viết đúng là trường hợp d.
Các trường hợp còn lại đều sai



a) O2 + 2Mn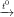 2MnO
2MnO
b) Fe203 + 3CO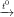 2Fe + 3CO2
2Fe + 3CO2
c) O2 + Si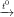 SiO2
SiO2
d) O2 + S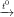 SO2
SO2
Phản ứng xảy ra trong quá trình luyện gang là (b), phản ứng xảy ra trong luyện thép là (a), (c), (d).
Chất oxi hóa là O2, Fe203; chất khử là Mn, CO, Si, S.
Phản ứng xảy ra trog quá trình luyện gang là b
b) Fe2O3 + CO → Fe + CO2
Phản ứng xảy ra trog quá tình luyện thép là
a) O2 + 2Mn → 2MnO
c) O2 + Si → SiO2
d) O2 + S → SO2
Chất oxi hóa là O2 và Fe2O3
Chất khử là : Mn ,CO , Si và S