Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Cho 27,2 gam hỗn hợp X gồm hai este có công thức phân tử C8H8O2 và đều chứa vòng benzen phản ứng vừa đủ với 250 ml dung dịch NaOH 1M, thu được m gam hỗn hợp hai muối. Giá trị m là
A. 25,2.
B. 20,1.
C. 26,4.
D. 25,0.

Đáp án: Axit có công thức phân tử là C4H8O2
Giải thích các bước giải:
Cách 1: Viết phương trình đốt cháy.
CnH2nO2 + 3n−22
O2 → nCO2 + nH2O
0,005n
← 0,005
⇒m(axit) = 0,11 = (14n+32).0,005n
⇒n = 4
⇒CTPT của axit là C4H8O2
Cách 2:
Quy đổi
OO:x
CH2:0,005
BTKL⇒x=0,00125(mol)
⇒Số cacbon =0,0050,00125
= 4⇒CTPT của axit là : C4H8O2

\(A+4HNO_3\to A\left(NO_3\right)_3+NO+2H_2O\)
\(3n_{NO}=n_{NO_3^-}=0,6\left(mol\right)\\ m=8,3+0,6.62=45,5g\)
\(\overline{M}\)\(=\dfrac{8,3}{0,2}=41,5\)(g/mol)
A chỉ có thể là Al
a+b=0,2
27a+Mb =8,3
M = 56 là nghiệm âm
Hay B là Fe

Hòa tan m g hh X (Fe, FeO, Fe2O3, Fe3O4) vào dd HCl dư thu được a mol H2 và 31,19g hh muối
Trung tâm gia sư - dạy kèm tại nhà N Đà Nẵng giới thiệu phần giải đáp thắc mắc nhằm hổ trợ cho các bạn có thêm tư liệu học tập. Chúc các bạn học tốt môn học này
Ngày đăng: 04-09-2019
7,699 lượt xem
nNaOH = 0,4 mol
nFe(OH)3 = 0,1 mol
khi cho NaOH vào dung dịch Y thu được dung dịch: Na+ 0,4 mol Fe3+ x mol và SO42- 0,41 mol
theo ĐLBT điện tích: 3x + 0,4.1 = 0,41.2
→ x = 0,14 mol
→ tổng số mol Fe3+ trong Y = 0,14 + 0,1 = 0,24 mol
Cho X vào dung dịch H2SO4 đặc
Fe → Fe+3 + 3e
0,24 0,72
O + 2e → O-2
y 2y
S+6 + 2e → S+4
0,28 0,14
Theo ĐLBT electron: 0,72 = 2y + 0,28
→ y = 0,22 mol
Ta có: nCl- = (31,19 – 0,24.56)/35,5 = 0,5 mol
→ nH+ = 0,5 mol
Theo ĐLBT nguyên tố H: 2nH2 + 2nH2O = nHCl
→ nH2 = (0,5 – 0,22.2)/2 = 0,03 mol

Công thức tổng quát của kim loại là \(M\).
Phương trình: \(MCO_3+2HCl\rightarrow MCl_2+CO_2+H_2O\)
\(n_{MCO_3}=n_{MCl_2}\Rightarrow\frac{42,6}{M+60}=\frac{47,55}{M+71}\Leftrightarrow M=34,\left(6\right)\)
Suy ra 2 kim loại là \(Mg,Ca\).
\(n_{CO_2}=n_{MCO_3}=\frac{42,6}{34,\left(6\right)+60}=0,45\)(mol)
Sử dụng sơ đồ đường chéo ta được: \(\frac{n_{MgCO_3}}{n_{CaCO_3}}=\frac{40-34,\left(6\right)}{34,\left(6\right)-24}=\frac{1}{2}\)
\(n_{MgCO_3}=0,15\)(mol) \(n_{CaCO_3}=0,3\)(mol)
\(m_{ddA}=m_m+m_{ddHCl}-m_{CO_2}=42,6+0,45.2.36,5\div20\%-0,45.44=187,05\)(g)
Từ đây bạn tính nồng độ nhé.

A. cộng hóa trị phân cực. B. cho nhận. C. Liên kết ion. D. cộng hóa trị.
Trả lời:
A.cộng hóa trị phân cực. B.cho nhận. C.ion. D.cộng hóa trị
:)))) HT

a.
CnH2n+H2Ni,to⟶CnH2n+2CmH2m−2+2H2Ni,to⟶CmH2m+2{CnH2n:xCmH2m−2:y→{x+y=100x+2y=160→{x=40y=60→%mol=%V{40%60%CnH2n+H2⟶Ni,toCnH2n+2CmH2m−2+2H2⟶Ni,toCmH2m+2{CnH2n:xCmH2m−2:y→{x+y=100x+2y=160→{x=40y=60→%mol=%V{40%60%
b.
Khi cho NaOH dư vào thu thêm được kết tủa nên dung dịch có muối Ca(HCO3)2.
CO2 + Ca(OH)2 → CaCO3↓ + H2O
0,5 ← 0,15
2CO2 + Ca(OH)2 → Ca(HCO3)2
Ca(HCO3)2 + 2NaOH → CaCO3↓ + Na2CO3 + 2H2O
0,1 ← 0,1
→ nCO2 = 0,1.2 + 0,5 = 0,7
Mặt khác: mdd giảm = mCaCO3 – mCO2 + mH2O
→ 9,12 = 50 – (44.0,7 + 18.nH2O) → nH2O = 0,56
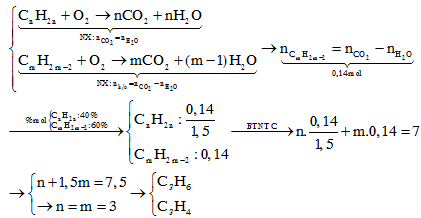

\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
0,4 1,2 0,4 mol
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3\downarrow+3NaCl\)
0,4 1,2 0,4 mol
\(n_{Al}=\frac{10,8}{27}=0,4mol\)
\(n_{HCl}=0,7.2=1,4mol\)
Ta có \(\frac{0,4}{2}< \frac{1,4}{6}\)
Vậy HCl dư và Al hết.
\(n_{NaOH}=0,75.2=1,5mol\)
Ta có \(\frac{0,4}{1}< \frac{1,5}{3}\)
Vậy NaOH dư và \(AlCl_3\) hết.
\(m_{Al\left(OH\right)_3}=0,4.78=31,2g\)

Gọi nFe=a mol nR=b mol
Phần 1
Fe+H2SO4\(\rightarrow\)FeSO4+H2
2R+nH2SO4\(\rightarrow\)R2(SO4)n+nH2
nH2=\(\frac{17,92}{22,4}\)=0,8 mol
Ta có
a+bn/2=0,8
Phần 2
nSO2=\(\frac{20,16}{22,4}\)=0,9 mol
Ta có
3a+bn=0,9.2
\(\rightarrow\)a=0,2 mol
b=1,2/n
mR=44-0,4.56=21,6 g
\(\rightarrow\)MR=21,6:2,4/n=9n
\(\rightarrow\)n=3 thì MR=27 R là Al

Giải thích các bước giải:
Thuỷ phân 2 este tạo 2 muối nên CTCT là:
{HCOOCH2C6H5:xHCOOC6H4−CH3:y{HCOOCH2C6H5:xHCOOC6H4−CH3:y
nX=27,2136=0,2(mol)nX=27,2136=0,2(mol)
nNaOH=0,25(mol)nNaOH=0,25(mol)
→{x+y=0,2x+2y=0,25→{x+y=0,2x+2y=0,25
→{x=0,15y=0,05→{x=0,15y=0,05
Muối: {HCOONa:0,2CH3C6H4ONa:0,05{HCOONa:0,2CH3C6H4ONa:0,05
→m=20,1g
vậy là đáp án B