Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tính oxi hóa:F2>Cl2>Br2>I2.phản ứng minh họa:
Flo phản ứng mãnh liệt với hiđro ở nhiệt độ thấp (-250 độ C):F2+H2--->2HF
Clo phản ứng với hidro trong điều kiện nhiệt độ và ánh sáng:Cl2+H2---->2HCl,
Brom phản ứng với hidro trong nhiệt độ cao:Br2+H2--to->2HBr,
Iot phản ứng với hiđro theo phản ứng thuận nghịch và cần xúc tác:I2+H2-<-->2HI.

1. Để dung dịch H2S lâu ngày trong không khí thì có hiện tượng dung dịch dần trở nên vẩn đục và có màu vàng do Oxi trong không khí đã Oxi hóa chậm H2S thành
H2S + O2 --> SO2 + H2O
(Xin lỗi ở trên mik quên ko cân bằng phương trình)
1. Để dung dịch H2S lâu ngày trong không khí thì có hiện tượng dung dịch dần trở nên vẩn đục và có màu vàng do Oxi trong không khí đã Oxi hóa chậm H2S thành
2H2S + 3O2 --> 2SO2 + 2H2O

1.Trong các hiđrohalogenua, tính khử tăng theo thứ tự sau:
a) HF<HCl<HBr<HI
b) HCL<HI<HBR<HF
c) HF<HBR<HCL<HI
d) HI< HBr<HCL<HF
2) A
Do nguyên tử I có bán kính lớn nhất trong các halogen nên liên kết H-I là dài nhất trong các liên kết H-X của hidro halogenua \(\rightarrow\) Liên kết dễ bị phá vỡ nhất vì vùng xen phủ ở xa hạt nhân nhất\(\rightarrow\) H trong HI dễ dàng bị tách ra tạo ion H+. Vậy HI có tính axit mạnh nhất.
3) D
Trong nhóm halogen, flo có độ âm điện lớn nhất nên dễ dàng hút e về phía mình tạo ion F-. Vậy F2 có tính oxh lớn nhất.

2NaCl----đpnc----> 2Na+Cl2
Cl2+2NaBr----> 2NaCl+Br2
Br2+2NaI-----> 2NaBr+I2
2K+I2--to-->2 KI
\(2NaCl\rightarrow2Na+Cl_2\uparrow\)
\(Cl_2+HBr\rightarrow2HCl+Br_2\)
\(2NaI+Br_2\rightarrow2NaBr+I_2\downarrow\)
\(2K+I_2\rightarrow2KI\)

Chọn đáp án D
C l 2 + 2NaBr → 2NaCl + B r 2
C l 2 có thể oxi hóa được B r - thành B r 2 → tính oxi hóa của C l 2 mạnh hơn B r 2 .
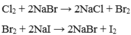
Ko thể vì
F2+H2O->HF+H2O
Cl2+H2O->HCl+HClO
Br2 ko tan nổi trên mặt nước
I2 ko tan chìm xuống nước