Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong 100ml dung dịch X có 0,1 mol Ba2+, 0,15 mol HCO3-
Trong 200ml dung dịch X có 0,2 mol Cl-
Do đó trong 50ml dung dịch X có 0,05 mol Ba2+, 0,075 mol HCO3- , 0,05 mol Cl- và x mol K+.
Theo định luật bảo toàn điện tích được x = 0,025.
Khi cô cạn xảy ra quá trình: 2HCO3- ⟶ CO32- + CO2 + H2O
Do đó: n C O 3 2 - = 0 , 0375
Vậy khối lượng chất rắn khan thu được là: m K + + m B a 2 + + m C O 3 2 - + m C l - = 11 , 85 ( g a m )
Đáp án C

• ddX chứa các ion: Fe3+, SO42-, NH4+, Cl-. Chia dd thành hai phần bằng nhau
- P1 + NaOH → 0,03 mol NH3 + 0,01 mol Fe(OH)3↓
- P2 + BaCl2 dư → 0,02 mol BaSO4
• Dung dịch X sau khi chia thành hai phần bằng nhau:
nNH4+ = 0,03 mol; nFe3+ = 0,01 mol; nSO42- = 0,02 mol.
Theo BTĐT: nCl- = 0,03 + 0,01 x 3 - 0,02 x 2 = 0,02 mol.
mX = 2 x (0,02 x 35,5 + 0,03 x 18 + 0,01 x 56 + 0,02 x 96) = 7,46 gam
Đáp án B

Chọn đáp án C
Xét trong 100 ml dung dịch X: 2H⁺ + CO32– → CO2 + H2O ⇒ nCO32– = nkhí = 0,1 mol.
Ba2+ + CO32– → BaCO3 || Ba2+ + SO42– → BaSO4 ⇒ nSO42– = (43 - 0,1 × 197) ÷ 233 = 0,1 mol.
NH4+ + OH– → NH3 + H2O ⇒ nNH4+ = nNH3 = 0,4 ÷ 2 = 0,2 mol.Bảo toàn điện tích: nNa+ = 0,2 mol.
⇒ mmuối trong 300ml X = 3 × (0,2 × 23 + 0,2 × 18 + 0,1 × 60 + 0,1 × 96) = 71,4(g) ⇒ chọn C.

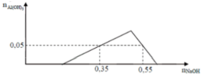
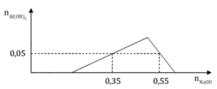
Tại nOH- = 0,35 thì Al(OH)3 chưa đạt cực đại ⇒ Al3+ còn dư
H+ + OH- → H2O
Al3+ + 3OH- → Al(OH)3
⇒ nOH- = nH+ + 3n↓ ⇒ 0,35 = x + 3.0,05 ⇒x = 0,2
Tại nOH- = 0,55 thì Al(OH)3 đạt cực đại và bị tan bớt 1 phần
H+ + OH- → H2O
0,2 → 0,2
Al3+ + 3OH- → Al(OH)3
y → 3y → y
Al(OH)3 + OH- → AlO2- + 2H2O
(y – 0,05) → (y – 0,05
⇒ nOH- = 0,2 + 3y + y – 0,05 = 0,55 ⇒ y = 0,1
Bảo toàn điện tích ⇒ 0,2 + 0,1.3 = 2z + 0,1 ⇒z = 0,2
Khi cho 0,27 mol Ba(OH)2 vào dung dịch X thì
Ba2+ + SO42- → BaSO4↓
0,2 → 0,2
H+ + OH- → H2O
0,2 → 0,2
Al3+ + 3OH- → Al(OH)3
0,1 → 0,3 → 0,1
Al(OH)3 + OH- → AlO2- + 2H2O
0,04 ← 0,04
⇒ mY = mBaSO4 + mAl(OH)3 = 0,2.233 + 0,06.78 = 51,28g ⇒ Chọn D.

Đáp án A
● Bảo toàn nguyên tố Clo: x = nAgCl = 86,1 ÷ 143,5 = 0,6 mol.
Bảo toàn điện tích: y = (0,2 + 0,6 – 0,1 × 3 – 0,2 × 2) ÷ 2 = 0,05 mol.
► NaOH + X → ghép ion. Ghép 0,2 mol NaNO3 và 0,6 mol NaCl
||⇒ dư 0,05 mol Na+ ghép với AlO2– ⇒ còn 0,05 mol Al cho Al(OH)3.
► Kết tủa gồm 0,05 mol Al(OH)3; 0,2 mol Mg(OH)2; 0,05 mol Cu(OH)2.
||⇒ m↓ = 0,05 × 78 + 0,2 × 58 + 0,05 × 98 = 20,4(g)

Đáp án A
● Bảo toàn nguyên tố Clo:
x = nAgCl = 86,1 ÷ 143,5 = 0,6 mol.
Bảo toàn điện tích: y = (0,2 + 0,6 – 0,1 × 3 – 0,2 × 2) ÷ 2 = 0,05 mol.
► NaOH + X → ghép ion.
Ghép 0,2 mol NaNO3 và 0,6 mol NaCl
||⇒ dư 0,05 mol Na+ ghép với AlO2–
⇒ còn 0,05 mol Al cho Al(OH)3.
► Kết tủa gồm 0,05 mol Al(OH)3; 0,2 mol Mg(OH)2; 0,05 mol Cu(OH)2.
||⇒ m↓ = 0,05 × 78 + 0,2 × 58 + 0,05 × 98 = 20,4(g)

Gọi x, y, z lần lượt là số mol Al3+ , Fe2+, SO42- trong dung dịch X. Ta có: nCl- = 3x + 2y - 2z (bảo toàn điện tích)
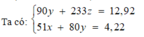
m = 162,5x + 127y + 25z
⇒ 7,58 <m< 14,83
Đáp án D

Phân tích thí nghiệm của dung dịch X với NaOH
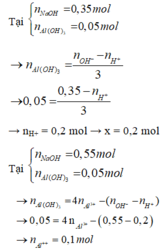

Thí nghiệm 2
Đáp án C
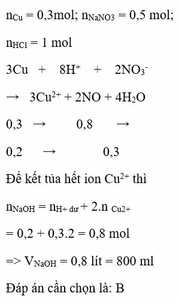
\(Ba^{2+} + SO_4^{2-} \to BaSO_4\)
Trong 500 ml dung dịch X:
\(n_{SO_4^{2-}} = 2n_{BaCl_2} = 2.0,1.2 = 0,4(mol)\)
\(Al^{3+} + 3NH_3 + 3H_2O \to Al(OH)_3 + 3NH_4^+\)
\(n_{Al^{3+}} = n_{Al(OH)_3} = \dfrac{7,8}{78} = 0,1(mol)\)
Bảo toàn điện tích : \(n_{Cu^{2+}} = \dfrac{0,4.2-0,1.3}{2} = 0,25(mol)\)
Suy ra : mmuối = 0,1.27 + 0,25.64 + 0,4.96 = 57,1(gam)