Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ba(OH)2 + SO2 ----> BaSO3 + H2O
0,4 0,4
nBa(OH)2 = Vdd * CM = 0,4 * 0,1 = 0,4 (mol)
VSO2 = n * 22,4 = 0,4 * 22,4 = 8,96 (l)

9
nSO2 = 4,48 : 22,4 = 0,2 (mol) ; nNaOH = 16: 40 = 0,4 (mol)
Ta thấy nNaOH/ nSO2 = 2 => chỉ tạo muối Na2SO3
=> mNa2SO3 = 0,2. 126 = 25, 2(g) =>D
10
nBa(OH) = 0,15.1 = 0,15mol; nBaCO3 = 19,7 : 197 = 0,1mol
Vì nBaCO3 < nBa(OH)2 → xét 2 trường hợp
Trường hợp 1: Ba(OH)2 dư, CO2 hết, phản ứng chỉ tạo muối cacbonat
CO2 + Ba(OH)2 → BaCO3 + H2O
0,1 0,1
Vậy V = VCO2 = 0,1.22,4 =2,24
Trường hợp 2: Phản ứng sinh ra 2 muối cacbonat và hiđrocacbonat
CO2 + Ba(OH)2→ BaCO3 + H2O (1)
0,1 0,1 0,1
2CO2+Ba(OH)2→Ba(HCO3)2
0,1 0,05
Theo phương trình (1): nBa(OH)2(1) = nBaCO3=0,1mol
Mà nBa(OH)2= 0,15mol →nBa(OH)2 (2) = 0,15−0,1 = 0,05mol
Theo (1) và (2): nCO2 = nBaCO3 + 2nBa(OH)2 (2) = 0,1 + 2.0,05 = 0,2 mol
Vậy V = VCO2 = 0,2.22,4 = 4,48 lít
=>A

Ta có: \(n_{SO_2}=\dfrac{0,448}{22,4}=0,02\left(mol\right)\)
PT: \(SO_2+2NaOH\rightarrow Na_2SO_3+H_2O\)
___0,02______0,04_______0,02 (mol)
mNa2SO3 = 0,02.126 = 2,52 (g)
Số mol của khí là 0,02 mol.
Số mol NaOH pư là 0,04 mol.
Giá trị của m là 2,52 gam.

\(CaO+H_2O\rightarrow Ca\left(OH\right)_2\)
\(n_{CaO}=n_{Ca\left(OH\right)_2}=\dfrac{3,36}{56}=0,06\left(mol\right)\)
\(n_{CaCO_3}=\dfrac{1,2}{100}=0,012\left(mol\right)\)
TH1: CO2 hết, Ca(OH)2 dư
PTHH: Ca(OH)2 + CO2 -----> CaCO3 + H2O
0,012 -> 0,012 mol
=> VCO2 = 0,012 . 22,4 = 0,27 (l)
TH2: CO2 dư
PTHH: Ca(OH)2 + CO2 -> CaCO3 + H2O
0,06 ..............0,06......0,06
CO2 + CaCO3 + H2O -> Ca(HCO3)2
0,048<--(0,06 - 0,012)
=> nCO2 = 0,06 + 0,048 = 0,108 mol
=> VCO2 = 0,108 . 22,4 = 2,42 (l)

\(n_{SO_2}= \dfrac{7,84}{22,4}=0,35 mol\)
\(n_{Ca(OH)_2}= 0,2 . 1,4=0,28mol\)
Ta có:
\(T=\dfrac{n_{nhóm OH}}{n_{SO_2}}\)\(=\dfrac{2. 0,28}{0,35}= 1,6\)
Có: 1<T<2
Nên Phản ứng tạo hỗn hợp 2 muối trung hòa và axit
\(Ca(OH)_2 + SO_2 \rightarrow CaSO_3 + H_2O\) (1)
\(CaSO_3 + SO_2 + H_2O \rightarrow Ca(HSO_3)_2\) (2)
Theo PTHH (1):
\(n_{SO_2(1)}\)\(n_{CaSO_3} = n_{Ca(OH)_2}= 0,28mol\)
\(\Rightarrow n_{SO_2(2)}=0,35 - 0,28= 0,07 mol\)
Theo PTHH (2):
\(n_{CaSO_3bị hòa tan}\)\(=\)\(n_{Ca(HSO_3)_2}= n_{SO_2(2)}= 0,07 mol\)
Suy ra: \(n_{CaSO_3 sau pư}= 0,28 - 0,07= 0,21 mol\)
\(m_{muối}= m_{CaSO_3} + m_{Ca(HSO_3)_2}= 0,21 .120 + 0,07 . 202= 39,34g\)
b)
\(C_{M Ca(HSO_3)_2}= \dfrac{0,07}{0,2}= 0,35M\)

a) Mg+ 2H2SO4→ MgSO4+ SO2+ 2H2O
(mol) 0,2 0,4 0,2
nMg=\(\dfrac{m}{M}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
V SO2= n.22,4= 0,2.22,4= 4,48 (lít)
b) Ta có: CM H2SO4= \(\dfrac{n}{V}\)
<=> V H2SO4= \(\dfrac{n}{C_M}\)=\(\dfrac{0,4}{2}=0,2\left(lít\right)\)
Số mol của magie
nMg = \(\dfrac{m_{Mg}}{M_{Mg}}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
Pt : Mg + H2SO4 → MgSO4 + H2\(|\)
1 1 1 1
0,2 0,2 0,2
a) Số mol của khí hidro
nH2 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Thể tích của khí hidro
VH2 = nH2 . 22,4
= 0,2 . 22,4
= 4,48 (l)
b) Số mol của axit sunfuric
nH2SO4 = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Thể tích của dung dịch axit sunfuric đã dùng
CMH2SO4 = \(\dfrac{n}{V}\Rightarrow V=n.C_M=0,2.2=0,4\left(l\right)\)
Chúc bạn học tốt
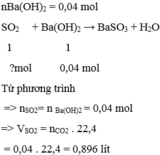
TH1 :nBa(OH)2 = 0,04 mol
SO2 + Ba(OH)2 → BaSO3 + H2O
Tỉ lệ 1 1
Phản ứng ?mol 0,04 mol
Từ phương trình => nSO2= n Ba(OH)2 = 0,04 mol
=> VSO2 = nCO2 . 22,4 = 0,04 . 22,4 = 0,896 lít
TH2:
Ba(OH)2+2SO2->Ba(HSO4)2
0,04-------0,08 mol
=>VSO2=0,08.22,4=1,792l