Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

gọi M là ct của kim loại đó
ta có ptpư:
2 M + xCl2 >>>2 MClx
2M g 2 M + 71x g
3,6g 14,25g
ta có: 28,5M=7,2M + 255,6x
21,3M =255,6x
M=255,6x/21,3
nếu x=1>>>M=12(loại vì đó là fi kim)
x=2>>>M=24(nhận vì là kim loại)
>>> M là Mg

Bài này tương tự, tham khảo.
Hỗn hợp A gồm oxit của một kim loại hoá trị II và muối cacbonat của kim loại đó được hoà tan hết bằng axit HCl vừa đủ tạo ra khí B và còn dung dịch D. Đem cô cạn D thu được một lượng muối khan bằng 168% lượng A. Biết khối lượng khí B bằng 44% lượng A. Hỏi kim loại hoá trị II nói trên là nguyên tố nào ? % lượng mỗi chất trong A bằng bao nhiêu.
Bài làm
Gọi kim loại hóa trị II là R, có nguyên tử khối là R (R > 0), x là số mol của RO (x > 0)
Theo bài ra ta có các PTHH :
RO + H2SO4 \(\rightarrow\) RSO4 + H2O
RCO3 + H2SO4 \(\rightarrow\) RSO4 + CO2\(\uparrow\) + H2O
Giả sử khối lượng của A đem tham gia p.ứng là 100g thì khối lượng RSO4 = 168g và khối lượng CO2 = 44g \(\approx\) 1 mol.
Theo giả sử ta có : (R + 16)x + R + 60 = 100 (1)
Theo phương trình ta có : (R + 96)x + R + 96 = 168 (2)
Từ (1), (2) \(\Rightarrow\) x = 0,4
R \(\approx\) 24 \(\Rightarrow\) Mg
Phần trăm khối lượng của oxit là : %MgO = 16%
Phần trăm khối lượng của muối là : %MgCO3 = 84%
chép mạng . Không tính. Mới có lớp 7 làm sao nổi hóa lớp 8 chứ không ns đến lớp 10

Gọi \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{1,33}{22,4}=0,059375\left(mol\right)\)
PTHH:
Zn + 2HCl ---> ZnCl2 + H2
a a
Fe + 2HCl ---> FeCl2 + H2
b b
Hệ pt \(\left\{{}\begin{matrix}65a+56b=3,73\\a+b=0,059375\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,045\left(mol\right)\\b=0,014375\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Zn}=0,045.65=2.925\left(g\right)\\m_{Fe}=0,014375.56=0,805\left(g\right)\end{matrix}\right.\\ \rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{2,925}{3,73}=78,42\%\\\%m_{Fe}=100\%-78,42\%=21,58\%\end{matrix}\right.\)

Xét 1 mol kim loại ứng với R (gam) tham gia phản ứng.
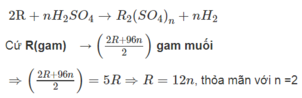
Vậy R=24 (Mg)

a) PTHH: Fe + S --to--> FeS
Zn + S --to--> ZnS
FeS + 2HCl --> FeCl2 + H2S
ZnS + 2HCl --> ZnCl2 + H2S
Fe + 2HCl --> FeCl2 + H2
Zn + 2HCl --> ZnCl2 + H2
b)
Gọi số mol Zn, Fe là a, b (mol)
=> 65a + 56b = 3,72 (1)
Theo PTHH: \(a+b=n_{khí}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\) (2)
(1)(2) => a = 0,04 (mol); b = 0,02 (mol)
=> \(\left\{{}\begin{matrix}m_{Zn}=0,04.65=2,6\left(g\right)\\m_{Fe}=0,02.56=1,12\left(g\right)\end{matrix}\right.\)
c) \(\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{2,6}{3,72}.100\%=69,9\%\\\%m_{Fe}=\dfrac{1,12}{3,72}.100\%=30,1\%\end{matrix}\right.\)
Gọi \(\left\{{}\begin{matrix}n_{Zn}=x\\n_{Fe}=y\end{matrix}\right.\)
\(Zn+S\rightarrow\left(t^o\right)ZnS\)
x x x ( mol )
\(Fe+S\rightarrow\left(t^o\right)FeS\)
y y y ( mol )
\(n_{H_2S}=\dfrac{1,344}{22,4}=0,06mol\)
\(ZnS+2HCl\rightarrow ZnCl_2+H_2S\)
x x ( mol )
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
y y ( mol )
Ta có:
\(\left\{{}\begin{matrix}97x+88y=3,72+32\left(x+y\right)\\x+y=0,06\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}97x+88y=5,64\\x+y=0,06\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}x=0,04\\y=0,02\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Zn}=0,04.65=2,6g\\m_{Fe}=0,02.56=1,12g\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{2,6}{3,72}.100=69,89\%\\\%m_{Fe}=100\%-69,89\%=30,11\%\end{matrix}\right.\)

Áp dụng định luật bảo toàn khối lượng:
`m_(Cl_2)=19-4,8=14,2(g)`
`=>n_(Cl_2)=(14,2)/(71)=0,2(mol)`
PTHH: \(M+Cl_2 \rightarrow MCl_2\) (có điều kiện `t^o)`
Từ đó ta suy ra `n_(M)=0,2(mol)`
`=>M=(4,8)/(0,2)=24`
`=>M` là `Mg` (Magiê)

\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(2A+2nH_2O\rightarrow2A\left(OH\right)_n+nH_2\)
\(\dfrac{0.1}{n}........................0.05\)
\(M_A=\dfrac{3.9}{\dfrac{0.1}{n}}=39n\)
Với : \(n=1\rightarrow A=39\)
\(A:K\)
\(m_{KOH}=0.1\cdot56=5.6\left(g\right)\)
\(m_{ddX}=3.9+46.2-0.05\cdot2=50\left(g\right)\)
\(C\%_{KOH}=\dfrac{5.6}{50}\cdot100\%=11.2\%\)
\(b.\)
\(K_2O+H_2O\rightarrow2KOH\)
\(0.1....................0.2\)
\(m_{KOH}=0.2\cdot56=11.2\left(g\right)\)
\(m_{dd_X}=\dfrac{11.2}{28\%\%}=40\left(g\right)\)
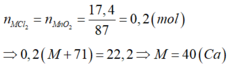
\(n_X=\dfrac{3,6}{M_X}\left(mol\right)\)
PTHH: X + S --to--> XS
\(\dfrac{3,6}{M_X}\)-------->\(\dfrac{3,6}{M_X}\)
=> \(\dfrac{3,6}{M_X}\left(M_X+32\right)=8,4\)
=> MX = 24 (g/mol)
=> X là Mg
X + S \(\underrightarrow{t^o}\) XS.
Ta có: \(\dfrac{3,6}{M_X}=\dfrac{8,4}{M_X+32}\) \(\Rightarrow\) MX=24 (g/mol). Vậy kim loại X là magie (Mg).