Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Giả sử nCuSO4 = nNaCl = 2 mol
CuSO4 + 2NaCl → Cu + Cl2 +Na2SO4 (1)
CuSO4 + H2O → Cu + 0,5O2 + H2SO4 (2)
H2O → H2 + 0,5O2
Sau t giờ thu được dung dịch X có hòa tan Al nên (1) đã điện phân hết, (2) đang điện phân.
(1) => nCuSO4(1) = 1
(2) => nCuSO4(2) = a
=>ne(t) = 2+2a
Sau 2t giờ:
(2) => nCuSO4(2) = nH2SO4 = 4a
=> nCuSO4 đp = 1+4a => ne(2t) = 2+8a
Nếu sau 2t giờ catot chưa sinh ra H2 thì ne(2t)=2ne(t) => 2+8a = 2(2+2a) => a=0,5
=> nH2SO4 = 2 (vô lí vì nH2SO4<nCuSO4 = 2)
Vậy sau 2t giờ catot đã sinh ra H2 (b mol), CuSO4 đã hết => nH2(H2SO4) = 4a = 1 => a = 0,25
BT e tại catot trong trong 2t giờ:
2nCu+2nH2 = 2(2+2a) => b = 0,5
Tại anot: nCl2 = 1 và nO2 = 0,75 (Bte tính O2)
=> n khí tổng = 2,25 = 9a => A đúng
Sau 1,75t giờ thì ne = 1,75(2+2a) = 4,375 > 2nCu2+ = 4 nên catot đã có khí thoát ra => B đúng
Sau 1,5t giờ thì ne = 1,5(2+2a) = 3,75 < 2nCu2+ = 4 nên Cu2+ chưa hết => C đúng
Sau 0,75t giờ thì ne = 0,75(2+2a) = 1,875 < nCl- = 2 nên Cl- chưa hết, H2O chưa bị điện phân => D sai

Đáp án A
Tại t(h):
Catot: Cu + 2e → Cu Anot: 2Cl- → Cl2 + 2e
1 1
2H2O → 4H+ + O2 + 4e
8a + 2x 8a + 2x
Tại 2t(h)
Catot: Cu + 2e → Cu Anot: 2Cl- → Cl2 + 2e
1 2 1 0,5 1
2H2O + 2e → 2OH- + H2 2H2O → 4H+ + O2 + 4e
2x 2x x 8a + 2x 8a + 2x
Bảo toàn e ta có: 2 + 2x = 1+ 8a + 2x nên a = 0,125.
Ta có: n(e) tại 2t = 2n(e) tại t nên 1 +8a + 2x = (1+2a)´2
Tìm được x = 0,25
Như vậy: tại t(h) : n(e) = 1,25.
Suy ra:
+ tại 1,75t(h) : n(e) = 2,1875 > 2 nên Catot đã có khí
+ tại 2t(h) : n(H2) = 0,25; n (Cl2) = 0,5; n(O2) = 0,375 nên tổng khí = 1,125 = 9a
+ Tại 1,5t(h) : n(e) = 1,875 <2 nên Cu chưa điện phân hết
+ tại 0,75t (h) : n(e) = 0,9375 < 1 nên H2O (tại anot) chưa bị điện phân

Đáp án B
• Xét tại thời điểm th; dung dịch sau điện phân hòa tan Al sinh ra H2 mà tỷ lệ CuSO4 : NaCl = 1:1 nên.
Đặt số mol CuSO4 và NaCl đều là b mol.
Ở catot: Cu2+ + 2e → Cu0; ở anot: 2Cl- - 2e → Cl2 ; 2H2O – 4e → 4H+ + O2.
Dung dịch X Phản ứng với Al sinh ra a mol H2 → lượng H+ đã phản ứng = 2a mol.
→ Số mol e trao đổi = b + 2a mol .
• Xét tại thời điểm 2th, số mol e trao đổi = 2 (2a + b) mol.
Ở catot: Cu2+ + 2e → Cu0 ; 2H2O + 2e → 2OH- + H2 || Ở anot: 2Cl- - 2e → Cl2 ; 2H2O – 4e → 4H+ + O2.
Số mol e Cl- nhường = b mol → số mol e H2O nhường = 4a + b mol → Lượng H+ sinh ra = 4a + b
Số mol e Cu2+ nhận = 2b mol → Số mol e H2O nhận = 4a mol → số mol OH- = 4a mol.
Trong dung dịch có OH- và H+ nên : H+ + OH- → H2O.
→ Lượng H+ dư = b mol.
Cho Al dư vào dung dịch: Al + 3H+ → Al3+ + 3/2 H2.
→ Số mol H2 = b /2 = 4a → a : b = 1 : 8
• Xét các nhận định:
+ Tại thời điểm 2th số mol khí thoát ra ở hai cực là: 2a + 0,5 b + 0,25 (4a + b ) , thay b = 8 a → số mol khí thoát ra = 9a mol → (1) đúng.
+ Tại thời điểm 1,75t h thì số mol e trao đổi = 1,75 (2a + b) mol.
Nếu H2O điện phân thì Cu2+ điện phân hết → số mol e Cu2+ nhận = 2b mol < 1,75 (2a + b)
→ 0,25b < 3,5a → a : b < 1 / 3 đúng (do a : b = 0,75). → (2) đúng.
+ Tại thời điểm 1,5t h thì số mol e trao đổi = 1,5 (2a + b) mol.
Nếu H2O điện phân thì Cu2+ điện phân hết → số mol e Cu2+ nhận = 2b mol < 1,5 (2a + b)
→ 0,5b < 3a → a : b < 1 / 6 → đúng (do a : b = 1:8 ). → (3) đúng.
+ Tại thời điểm 0,8t h thì số mol e trao đổi = 0,8 (2a + b) mol.
Nếu H2O điện phân thì Cl- điện phân hết → số mol e Cl- nhường= b mol < 0,8 (2a + b)
→ 0,2b < 1,6 a → a : b < 1 / 8 đúng (do a : b = 1:8). → (4) đúng.
+ Tại thời điểm 2th thì số mol H2 sinh ra = 2a mol. → (5) sai.

MgCO3 + 2HCl → MgCl2 + CO2 + H2O (1)
BaCO3 + 2HCl → BaCl2 + CO2 + H2O (2)
CO2 + Ca(OH)2 → CaCO3↓ + H2O. (3)
Theo (1), (2) và (3), để lượng kết tủa B thu được là lớn nhất thì:
nCO2 = nMgCO3 + nBaCO3 = 0,2 mol
Ta có: 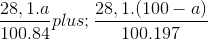 = 0,2
= 0,2
=> a = 29,89.

PTPU:
C2H2 + 2H2 \(\rightarrow\) C2H6
x \(\rightarrow\) 2x \(\rightarrow\) x
C2H2 + H2 \(\rightarrow\) C2H4
y \(\rightarrow\) y \(\rightarrow\) y
Gọi x, y lần lượt là số mol của C2H2 tham gia phản ứng.
\(n_{\text{kết tủa}}\) = 24/240 = 0,1 mol => \(n_{C_2H_2\left(dư\right)}\) = 0,1 mol
Vì ta thấy rằng tỉ khối hơi của X so với H2 bằng 8, từ đây ta biết được một điều là H2 dư sau phản ứng.
Vậy sau phản ứng ta có hỗn hợp khí X gồm:
C2H2 (dư) = 0,1 mol
H2 (dư) = 0,65 – (2x + y)
C2H4 = y mol
C2H6 = x mol
hỗn hợp khí X có tỉ khối so với H2 bằng 8. Ta có phương trình:
[26 . 0,1 + (0,65 – 2x – y) .2 + 30.x + 28.y]/(0,1 + 0,65 – 2.x – y + x +y) = 8.2 = 16
\(\Rightarrow\) 42x + 26y = 8,1 (1)
Mà ta lại có phương trình
x + y = 0,35 – 0,1 = 0,25 ( số mol C2H2 tham gia phương trình phản ứng) (2)
Từ (1) và (2) ta có hệ phương trình:
\(\Rightarrow\) x = 0,1 mol
y = 0,15 mol
Sau phản ứng hỗn hợp khí Y gồm C2H6 (0,1 mol) và C2H4 (0,15 mol)
Vậy sẽ có 0,15 mol Br2 tham gia phản ứng.

Số mol H3PO4: 0,050 x 0,50 = 0,025 (mol).
H3PO4 + 3NaOH → Na3PO4 + 3H2O
1 mol 3 mol
0,025 mol 3 x 0,025 mol
Thể tích dung dịch NaOH: 0,075 lít hay 75 ml



Đáp án A
Nhận thấy dung dịch Y có nhiều H+ hơn dung dịch X.
Gọi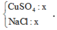
Tại thời điểm t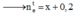
Tại thời điểm 2t → Có OH- sinh ra ở bên catot là 0,4 mol.
→ Có OH- sinh ra ở bên catot là 0,4 mol.