Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D.
Tại anot có khí Cl2 (0,5a mol) và O2 → BT : e n O 2 = 2 a - 0 , 5 a . 2 4 = 0 , 25 a mol ⇒ V = 16 , 8 a

Đáp án B
Ta có: ![]()
Điện phân X đến khi dung dịch giảm 24,88 gam thì dừng. Dung dịch thu được 2 chất tan. Cho Mg vào Y thấy thành Mg giảm 3,36 gam chứng tỏ có H+.
Do vậy hai chất tan trong Y là H2SO4 và Na2SO4
![]()
Cu2+ bị điện phân hết và có sinh ra 0,28 mol H+
=> 
Dung dịch bị giảm do Cu2+, Cl- và H2O bị điện phân.
![]()
![]()
Giải được: x=0,01.
Vậy ở anot thu được 0,1 mol Cl2 và 0,075 mol O2.
![]()

Giải thích: Đáp án C
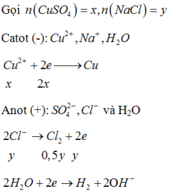
Do dung dịch X là phenol phâtlein hóa hồng nên dung dịch X có MT bazơ nên dung dịch sau phản ứng hòa tan Al2O3 là OH-; (H2O đã điện phân bên catot, còn anot chưa đp H2O)
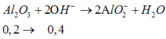
Suy ra n(Cl2) = n (khí anot) = 0,4=0,5y; vậy y=0,8
Bảo toàn e có n(e trao đổi) = 2x+0,4=y=0,8, nên x=0,2
Vậy m = 160.0,2 + 58,5.0,8 = 78,8

nkhí = 4,48 : 22,4 = 0,2 (mol);
nAl2O3 = 15,3 : 102 = 0,15 (mol)
Có thể xảy ra:
Catot:
Cu2+ + 2e → Cu (1)
2H2O + 2e → 2OH- + H2↑ (2)
Anốt
Cl- → Cl2 +2e (3)
2H2O → 4H+ + O2 +4e (4)
Vì Al2O3 có thể bị hòa tan bởi OH- hoặc H+ nên có thể xảy ra 2 trường hợp sau:
TH1: Bên anot nước bị điện phân trước, không có (2) xảy ra.
Al2O3 + 6H+ → 2Al3+ + 3H2O
0,15→ 0,9 (mol)
=> nO2 = 1/4nH+ = 0,225 (mol) > 0,2 mol khí => loại
TH2: Bên catot nước bị điện phân trước, không có (4)
=> nCl2 = nkhí = 0,2 (mol) => ne trao đổi = 2nCl2 = 0,4 (mol)
Al2O3 + 2OH- → 2AlO2- + 2H2O
0,15→ 0,3 (mol)
=> nCu2+ = (0,4 – 0,3)/ 2 = 0,05 (mol)
=> m = mCuSO4 + mKCl = 0,05. 160 + 0,4. 74,5 = 37,8 (g)
Đáp án A

Đáp án A
nkhí = 4,48 : 22,4 = 0,2 (mol); nAl2O3 = 15,3 : 102 = 0,15 (mol)
Có thể xảy ra:
Catot: Anốt
Cu2+ + 2e → Cu (1) Cl- → Cl2 + 2e (3)
2H2O + 2e → 2OH- + H2↑ (2) 2H2O → 4H+ + O2 + 4e (4)
Vì Al2O3 có thể bị hòa tan bởi OH- hoặc H+ nên có thể xảy ra 2 trường hợp sau:
TH1: Bên anot nước bị điện phân trước, không có (2) xảy ra.
Al2O3 + 6H+ → 2Al3+ + 3H2O
0,15→ 0,9 (mol)
=> nO2 = 1/4nH+ = 0,225 (mol) > 0,2 mol khí => loại
TH2: Bên catot nước bị điện phân trước, không có (4)
=> nCl2 = nkhí = 0,2 (mol) => ne trao đổi = 2nCl2 = 0,4 (mol)
Al2O3 + 2OH- → 2AlO2- + 2H2O
0,15→ 0,3 (mol)
=> nCu2+ = (0,4 – 0,3)/ 2 = 0,05 (mol)
=> m = mCuSO4 + mKCl = 0,05. 160 + 0,4. 74,5 = 37,8 (g)

Đáp án A
- Phương trình điện phân
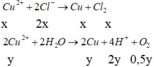
Có mdung dịch giảm = m Cu + m Cl 2 + m O 2 = 64 ( x + y ) + 71 x + 32 . 0 , 5 y = 20 , 815 gam
Cho (Mg, MgO) + dung dịch sau điện phân → 18,16g muối + 0,012mol khí Y
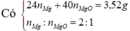
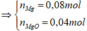
m muối = m Mg ( NO 3 ) 2 + m NH 4 NO 3 = 148 . ( 0 , 08 + 0 , 04 ) + 80 n NH 4 NO 3 = 18 , 16 g ⇒ n NH 4 NO 3 = 0 , 005 mol
+ Giả sử 1 mol N+5 nhận n mol e để chuyển thành N trong khí Y
Áp dụng bảo toàn electron có:
![]()
=> n = 10 => Khí Y là N2
m muối = m Mg ( NO 3 ) 2 + m NH 4 NO 3 = 148 . ( 0 , 08 + 0 , 04 ) + 80 n NH 4 NO 3 = 18 , 16 g ⇒ 2 y = 2 n Mg ( NO 3 ) 2 + 2 n NH 4 NO 3 + 2 n N 2 = 0 , 274 mol
=>Thời gian điện phân t = ( 0 , 137 + 0 , 073 ) . 2 . 96500 5 = 8016 s
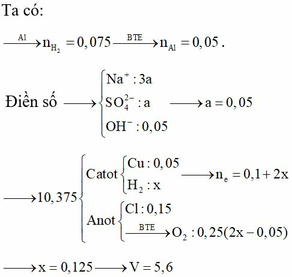

Chọn B.
11,2.