Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.




Chọn đáp án D.
Điện phân trong 2895s:
n đ i ệ n p h â n = 2895 . 2 96500 = 0 , 06 m o l > 2 . 0 , 02
⇒ n H 2 = 0 , 06 - 2 . 0 , 02 2 = 0 , 01 m o l
=> 0,02 mol khí còn lại gồm Cl2 (x mol) và O2 (y mol)
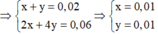
Trong khoảng thời gian từ (t + 2895) s đến 2s chỉ là điện phân H2O
nên phần khí tăng thêm là 2 , 125 a - a - 0 , 03 = 1 , 125 a - 0 , 03 chỉ gồm O2 và H2
Do n H 2 = 2 n O 2
nên n H 2 = 0 , 75 a - 0 , 02 n O 2 = 0 , 375 a - 0 , 01
Như vậy trong thời gian từ t đến 2t thì tại anot có:
⇒ n C l 2 = 0 , 01 m o l n O 2 = 0 , 374 a - 0 , 01 + y = 0 , 375 a
Bảo toàn electron cho cực dương ở 2 khoảng thời gian (0 – t) và (t – 2t) có:
![]()
![]()
![]()
Điện phân 5404 s:
n C u 2 + đ i ệ n p h â n = 5404 . 2 2 . 96500 = 0 , 056 m o l
⇒ n C u 2 + = 0 , 04 + 0 , 02 - 0 , 056 = 0 , 004 m o l
⇒ Tại anot đã xảy ra điện phân H2O:
n H + = 0 , 112 - 0 , 1 = 0 , 012 m o l
⇒ ∆ m t h a n h F e = - 0 ,...

Đáp án A
Gọi số mol e lúc t giây là x.
Túc t giây thu được a mol khí ở 2 điện cực và b mol Cu.
Lúc t+2895s thì số mol e là x+0,06 mol thì thu được a+0,03 mol khí và b+0,02 mol Cu.
Ta có: 0,02. 2 < 0,06
chứng tỏ lúc này Cu2+ hết ở catot thu được thêm 0,02 mol Cu và 0,01 mol H2.
Vậy ở anot thu được 0,02 mol khí do vậy khí này gồm cả Cl2 và O2, giải được số mol Cl2 và O2 đều là 0,01 mol.
Vậy lúc t giây thu được số mol Cu là 0,5x=b và khí chỉ là Cl20,5x=a.
Lúc 2t giây thu được 2,125a mol khí và a+0,02 mol Cu.
Số mol e lúc này là 2x.
Ở catot thu được số mol H2 là 2 x - 0 , 5 x + 0 , 02 . 2 2 = 0 , 5 x - 0 , 02 mol
Ở anot thu được Cl2 là 0,5x +0,01 mol và O2 2 x - 0 , 5 x + 0 , 01 . 2 4 = 0 , 25 x - 0 , 005
→ 0,5x - 0,02 +0,5x + 0,01 + 0,25x - 0,005 = 2,125a = 2,125.0,5x
Giải được: x=0,08.
Vậy dung dịch ban đầu chứa CuSO4 0,06 mol và NaCl 0,1 mol.
Dừng điện phân ở thời điểm 5404 giây tức số mol e là 0,112 mol.
Ở catot thu được Cu: 0,056 mol.
Ở anot thu được Cl2 0,05 mol và O2 0,003 mol.
Do vậy dung dịch sau điện phân chứa Cu2+ dư 0,004 mol, H+ 0,012 mol, Na+ và SO42-.
Khi cho thanh Fe vào thì khối lượng thanh Fe giảm đi 0,006.56 - 0,004(64 - 56) = 0,304 gam

Câu a:
Có 3 dd là: H2O, NaOH, HCl
Cho quỳ tím vào:
\(\rightarrow\) Hóa đỏ: HCl
\(\rightarrow\) Hóa xanh: NaOH
\(\rightarrow\) Không chuyển màu: H2O
Câu b:
Có 4 dd: H2O, Ca(OH)2 (ở dạng dd), H2SO4 loãng, NaCl.
+ Cho quỳ tím vào:
\(\rightarrow\) Hóa xanh: dd Ca(OH)2
\(\rightarrow\) Hóa đỏ: H2SO4 loãng
\(\rightarrow\) Không chuyển màu quỳ tím: H2O và NaCl -----nhóm A
Với nhóm A:
- Cách 1:
Cho dd AgNO3 vào mỗi chất trong nhóm A:
\(\rightarrow\) Tạo kết tủa với AgNO3: NaCl
NaCl + AgNO3 \(\rightarrow\)AgCl\(\downarrow\) + NaNO3
\(\rightarrow\) Không hiện tượng: H2O
Nếu bạn chưa học tới thì có thể dùng cách 2:
- Cách 2:
Lấy ít mẫu thử của H2O và NaCl đun nóng.
\(\rightarrow\) Bay hơi hết : H2O
\(\rightarrow\) Bay hơi còn lại chất rắn kết tinh : NaCl
a, trích 3 mau thử ra 3 ống nghiệm có mẩu quỳ tím
chất lam cho quỳ tím hóa đỏ là HCl
chất lam quý tím xanh la NaOH
còn lại quỳ tím ko đổi mau la H2O

Đáp án B
Tại thời điểm t = 200 (s): chỉ có khí Cl2 (x mol) tại anot Þ ne (1) = 2x mol
Tại thời điểm t = 350 (s): có khí Cl2 (x mol) và O2 Þ ne (2) = 3,5x mol → BT : e nCu = 1,75x
Tại thời điểm t = 450 (s): có khí Cl2 (x mol), O2, H2 Þ ne (3) = 4,5x mol
![]()

Tại thời điểm t = 250 (s) Þ ne = 0,2 mol Þ 
Dung dịch Y có chứa H+ (0,04 mol); Cu2+ (0,04 mol)
Khi cho Y tác dụng với Al thì: mAl tăng
![]()

Đáp án A
Tại thời điểm t = 200 (s): chỉ có khí Cl2 (x mol) tại anot Þ ne (1) = 2x mol
Tại thời điểm t = 350 (s): có khí Cl2 (x mol) và O2 Þ ne (2) = 3,5x mol → BT : e nCu = 1,75x
Tại thời điểm t = 450 (s): có khí Cl2 (x mol), O2, H2 Þ ne (3) = 4,5x mol
![]()
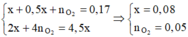
Tại thời điểm t = 250 (s) Þ ne = 0,2 mol Þ 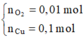
Dung dịch Y có chứa H+ (0,04 mol); Cu2+ (0,04 mol)
Khi cho Y tác dụng với Al thì: mdd giảm