Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
Theo đinh luật Faraday khối lượng nhôm thu được là
Hiệu suất là
(tham khảo)

Chọn C.
Theo đinh luật Faraday khối lượng nhôm thu được là :
mAl = AIt/ 96500 n = 27 x 9,65 x 3000 / 96500 x 3 = 2,7(g)
Hiệu suất là H = 2,16 / 2,7 x 100% = 80%.

Phương trình điện phân: 4AgNO3 + 2H2O → 4Ag + O2 + 4HNO3 (1)
Dung dịch Y gồm: AgNO3, HNO3. Cho Fe + dd Y sau phản ứng thu được 14,5g hỗn hợp kim loại nên Fe dư có các phản ứng:
3Fe + 8HNO3 → 3Fe(NO3)3 + 2NO + 4H2O (2)
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (3)
Gọi x là số mol AgNO3 bị điện phân® nHNO3 = x, dung dịch Y: HNO3: x mol; AgNO3 dư: 0,15 –x mol.
Theo (2,3) nFe phản ứng = 3x/8 + (0,15-x)/2 = 0,075 –x/8 mol
nAg = 0,15 – x mol
Vậy mhỗn hợp kim loại = mFedư + mAg =12,6 –(0,075-x/8).56 +(0,15-x).108 =14,5
Suy ra: x= 0,1 mol. Ta có mAg = 0,1.108 ® t = 1,0 h

Vì NaNO3 và NaOH dư, nên Al hết => ko có phản ứng giữa Al và NaOH.
8Al + 5OH- + 3NO3- + 2H2O --> 8AlO2- + 3NH3
0,8 mol--------------------------------------0,3 mol.
nNH3 = 0,3 mol
Vì H = 75%, nên số mol nNH3 thu được = 0,3.75/100 = 0,225 mol
=> V = 5,04 lít.
Vì NaNO3 và NaOH dư, nên Al hết => ko có phản ứng giữa Al và NaOH.
8Al + 5OH- + 3NO3- + 2H2O --> 8AlO2- + 3NH3
0,8 mol..................................................0,3 mol.
nNH3 = 0,3 mol
Vì H = 75%, nên số mol nNH3 thu được = 0,3.75/100 = 0,225 mol
=> V = 5,04 lít.

Sơ đồ quá trình điều chế
(C6H10O5)n + nH2O → nC6H 12O6 (1)
C6H12O6 → 2C2H5OH + 2CO2 (k) (2)
Khối lượng tinh bột là: .106 =2.105 gam
Từ phương trình (1) và (2) ta có khối lượng rượu etylic thu được là
.n.2.46 =113580,24 gam
Hiệu suất quá trình là :
H= .100=70%

Cho CH3CHO phản ứng với H2 (xúc tác Ni, đun nóng) thu được
A. HCOOH
B. CH3CH2OH
C. CH3COOH
D. CH3OH
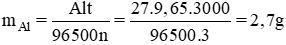
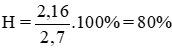
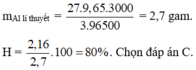


Đáp án C.
Theo đinh luật Faraday khối lượng nhôm thu được là
Hiệu suất là