Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 2:
Dd D gồm Ba(AlO2)2
\(\text{BaO+H2O}\rightarrow\text{Ba(OH)2}\)
\(\text{Ba(OH)2+Al2O3}\rightarrow\text{Ba(AlO2)2+H2O}\)
\(\text{CO2+Ba(AlO2)2+3H2O}\rightarrow\text{2Al(OH)3+Ba(HCO3)2}\)
Phần B không tan gồm FeO và Al2O3
\(\text{FeO+CO}\rightarrow\text{Fe+CO2}\)
\(\text{2Fe+Al2O3}\rightarrow\text{2Al+Fe2O3}\)
\(\text{Fe2O3+3CO}\rightarrow\text{2Fe+3CO2}\)
\(\rightarrow\) E gồm Fe và Al
\(\text{2Al+2NaOH+2H2O}\rightarrow\text{2NaAlO2+3H2}\)
\(\rightarrow\)G gồm Fe
\(\text{Fe+H2SO4}\rightarrow\text{FeSO4+H2}\)
\(\text{10FeSO4+2KMnO4+8H2SO4}\rightarrow\text{5Fe2(SO4)3+2MnSO4+K2SO4+8H2O}\)

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

Phương trình:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
FeSO4 + 2NaOH → Na2SO4 + Fe(OH)2↓
Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3↓
2Fe(OH)2 + ½ O2 → Fe2O3 + 2H2O
2Fe(OH)3 → Fe2O3 + 3H2O
Fe2O3 + 3CO → 2Fe + 3CO2↑
CO2 + Ca(OH)2 → CaCO3↓ + H2O
3CO2 + Ca(OH)2 → Ca(HCO3)2
Ca(HCO3)2 → CaCO3 + CO2↑ + H2O

Cho hỗn hợp X vào dung dịch HCl lấy dư:
PTHH: Al2O3 + 6HCl → 2AlCl3 + 3H2O
MgO + 2HCl → MgCl2 + H2O
Fe + 2HCl → FeCl2 + H2
Dung dịch Y gồm: AlCl3, MgCl2, FeCl2, HCl dư
Khí Z là H2
Chất rắn A là Cu
Cho A tác dụng với H2SO4 đặc nóng.
PTHH: Cu + 2H2SO4(đặc, nóng) → CuSO4 + SO2 + 2H2O
Khí B là SO2
Cho B vào nước vôi trong lấy dư
PTHH: SO2 + Ca(OH)2 → CaSO3 + H2O
Kết tủa D là CaSO3
Cho dung dịch NaOH vào Y tới khi kết tủa lớn nhất thì dừng lại.
PTHH: NaOH + HCl → NaCl + H2O
3NaOH + AlCl3 → Al(OH)3 + 3NaCl
2NaOH + MgCl2 → Mg(OH)2 + 2NaCl
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Chất rắn E là: Al(OH)3, Mg(OH)2, Fe(OH)2
Nung E trong không khí
Chất rắn G là Al2O3, MgO, Fe2O3

Phản ứng: CaCO3 → CaO + CO2
2Al + 3FeO →Al2O3 + 3Fe
(B gồm CaO, Cu, FeO, CaCO3 dư, Fe, Al)
CaO + H2O → Ca(OH)2
2Al + Ca(OH)2 + 2H2O →Ca(AlO2)2 + 3H2
Al2O3 + Ca(OH)2 →Ca(AlO2)2 + H2O
Do D không thay đổi khối lượng khi cho vào dung dịch NaOH, nên D không còn Al và Al2O3
Suy ra: D gồm Cu, FeO, CaCO3, Fe. Dung dịch C gồm Ca(AlO2)2, Ca(OH)2 dư.
CaCO3 + H2SO4 đặc →CaSO4 + CO2 + H2O
Cu + 2H2SO4 đặc →CuSO4 + 2H2O + SO2
2FeO + 4H2SO4 đặc →Fe2(SO4)3 + SO2 + 4H2O
2Fe + 6H2SO4 đặc → Fe2(SO4)3 + 3SO2 + 6H2O

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)
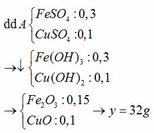
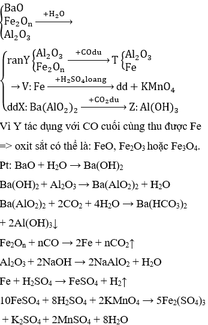






Bài 2: Hỗn hợp A gồm BaO, FeO, Al2O3. Hòa tan A trong lượng nước dư được dung dịch D và phần không tan B. Sục khí CO2 dư vào D, phản ứng tạo kết tủa. Cho khí CO dư qua B nung nóng được chất rắn E. Cho E tác dụng với dung dịch NaOH dư, thấy tan một phần và còn lại là chất rắn G. Hòa tan hết G trong lượng dư dung dịch H2SO4 loãng rồi cho dung dịch thu được tác dụng với dung dịch KMnO4. Giải thích thí nghiệm trên bằng các phương trình phản ứng.
________________________________________________________________________
A: BaO + FeO + Al2O3
B: FeO + Al2O3 dư
D: dd Ba(AlO2)2
E: Fe + Al2O3 dư
G: Fe
\(PTHH:BaO+H_2O\rightarrow Ba\left(OH\right)_2\)
\(Ba\left(OH\right)_2+Al_2O_3\rightarrow Ba\left(AlO_2\right)_2+H_2O\)
\(Ba\left(AlO_2\right)_2+4H_2O+2CO_2\rightarrow Ba\left(HCO_3\right)_2+2Al\left(OH\right)_3\)
\(FeO+CO\underrightarrow{t^o}Fe+CO_2\)
\(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(10FeSO_4+8H_2SO_4+2KMnO_4\rightarrow5Fe_2\left(SO_4\right)_3+8H_2O+2MnSO_4+K_2SO_4\)
Bài 3: Cho một lá sắt có khối lượng 5g vào 50ml dung dịch CuSO4 15% có khối lượng là 1,12g/ml. Sau một thời gian phản ứng, người ta lấy lá sắt ra khỏi dung dịch, rửa nhẹ, làm khô, cân nặng 5,16g. Tính nồng độ % các chất còn lại trong dung dịch sau phản ứng
_______________________________________________________________________
Gọi số mol Fe là x (mol)
\(PTHH:Fe+CuSO_4\rightarrow FeSO_4+Cu\)
(mol)_____x_____x_________x_____x__
(mol)
Theo đề bài ta có:
\(\Delta m=64x-56x=5,16-5\\ \Leftrightarrow8x=0,16\\ \Leftrightarrow x=0,02\left(mol\right)\)
\(m_{ddCuSO_4}=50.1,12=56\left(g\right)\\ n_{CuSO_4}=\frac{56.15}{100.160}=0,0525\left(mol\right)\)
Lập tỉ lệ: \(\frac{0,02}{1}< \frac{0,0525}{1}\rightarrow CuSO_4\) dư
\(m_{ddspu}=0,02.56+56-64.0,02=55,84\left(g\right)\)
\(C\%_{ddNaCl}=\frac{0,02.152}{55,84}.100\%=5,44\left(\%\right)\)
\(C\%_{ddCuSO_4\cdot du}=\frac{160.\left(0,0525-0,02\right)}{55,84}.100\%=9,31\left(\%\right)\)