Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{O_2}=\dfrac{1.68}{22.4}=0.075\left(mol\right)\)
\(4R+nO_2\underrightarrow{^{^{t^0}}}2R_2O_n\)
\(\dfrac{0.3}{n}....0.075\)
\(M_R=\dfrac{9.6}{\dfrac{0.3}{n}}=32n\)
Với : \(n=2\Rightarrow R=64\)
\(R:Cu\)
\(CuO:\) Đồng (II) oxit
nO2 = 0,075(mol)
PT
2R + O2 -> (đknd) 2RO
0,15 <- 0,075 (mol)
=> MR = m/n = 9,6 / 0,15 = 64 => R là Cu và oxit là CuO

a, \(n_{CO}=\dfrac{22,4}{22,4}=1\left(mol\right);n_{Fe}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3CO ---to→ 2Fe + 3CO2
Mol: 0,1 0,3 0,2
Ta có: \(\dfrac{0,1}{1}< \dfrac{1}{3}\) ⇒ Fe hết, CO dư
\(V_{CO}=0,3.22,4=6,72\left(l\right)\)
b, \(m_{Fe}=0,2.56=11,2\left(l\right)\)

\(n_{CO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Có nO(mất đi) = nCO2 = 0,15 (mol)
=> mrắn sau pư = 26,4 - 0,15.16 = 24(g)

a) FexOy+yCO→xFe+yCO2
b) +) Quy đổi 8g oxit sắt thành 8g (Fe; O). Khi đó, xảy ra phản ứng với CO
CO + O 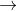 CO2
CO2
=> nCO (phản ứng) = nCO2
+) Lại có: M khí sau phản ứng = 2.d khí/H2 = 40 (g) ≠ MCO2
=> CO còn dư và O phản ứng hết
=> n hh sau = nCO ban đầu =  = 0,2 (mol)
= 0,2 (mol)
=> ∆m = m hh sau – mCO bđ = m Oxi (hh rắn) = 40.0,2 – 28.0,2 = 2,4 (g)
=> nCO2 = nO = 0,15 (mol)
=> mFe = 8 – 2,4 = 5,6 (g)
=> nFe = 0,1 (mol) ; nO = 0,15 (mol)
=> nFe : nO = 2 :3
=> CTPT oxit sắt là Fe2O3
Mặt khác, %V CO2/hh khí sau phản ứng = 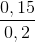 . 100% = 75%
. 100% = 75%
a)FexOy+yCO→xFe+yCO2
b)+) Quy đổi 8g oxit sắt thành 8g (Fe; O). Khi đó, xảy ra phản ứng với CO
CO + O 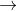 CO2
CO2
=> nCO (phản ứng) = nCO2
+) Lại có: M khí sau phản ứng = 2.d khí/H2 = 40 (g) ≠ MCO2
=> CO còn dư và O phản ứng hết
=> n hh sau = nCO ban đầu =  = 0,2 (mol)
= 0,2 (mol)
=> ∆m = m hh sau – mCO bđ = m Oxi (hh rắn) = 40.0,2 – 28.0,2 = 2,4 (g)
=> nCO2 = nO = 0,15 (mol)
=> mFe = 8 – 2,4 = 5,6 (g)
=> nFe = 0,1 (mol) ; nO = 0,15 (mol)
=> nFe : nO = 2 :3
=> CTPT oxit sắt là Fe2O3
Mặt khác, %V CO2/hh khí sau phản ứng = 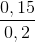 . 100% = 75%
. 100% = 75%

PTHH: FexOy + yCO =(nhiệt)=> xFe + yCO2
Ta có: nFexOy = \(\frac{2,32}{56x+16y}\left(mol\right)\)
nCO2 = \(\frac{0,896}{22,4}=0,04\left(mol\right)\)
\(\Rightarrow n_{FexOy}=\frac{0,04}{y}\left(mol\right)\)
\(\Rightarrow\frac{2,32}{56x+16y}=\frac{0,04}{y}\)
Giải ra, ta được \(\frac{x}{y}=\frac{3}{4}\)
=> CTHH : Fe3O4

\(n_{H_2}=\dfrac{8.96}{22.4}=0.4\left(mol\right)\)
\(BTKL:\)
\(m+0.4\cdot2=28.4+7.2\)
\(\Rightarrow m=34.8\left(g\right)\)
\(b.\)
\(m_{Fe}=0.59155\cdot28.4=16.8\left(g\right)\)
\(n_{Fe}=\dfrac{16.8}{56}=0.3\left(mol\right)\)
\(PTHH:\)
\(\dfrac{x}{y}=\dfrac{n_{Fe}}{n_{H_2}}=\dfrac{0.3}{0.4}=\dfrac{3}{4}\)
\(CT:Fe_3O_4\)

bạn ơi, cho mình hỏi làm sao lập được bảng đó vậy? chỉ mình với


nCO=0,04(mol)
Ta có:
nO=nCO=0,04(mol)
=>m=1,68+16.0,04=2,32(g)