Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi: M là NTK của R
a là số oxi hóa của R trong muối --> CTPT muối của R là R(2/a)CO3.
a) Từ nCO2 = n hỗn hợp = 0,5 nHCl = 3,36/22,4 = 0,15
--> nHCl = 0,15 x 2 = 0,3 mol nặng 0,3 x 36,5 = 10,95 gam.
--> dung dịch axit HCl 7,3% nặng 10,95/0,073 = 150 gam.
Mà
m dung dịch sau phản ứng = m dung dịch axit + m C - m CO2 bay ra
= 150 + 14,2 - (0,15 x 44) = 157,6 gam
--> m MgCl2 = 0,06028 x 157,6 = 9,5 gam
--> n MgCl2 = 9,5/95 = 0,1 mol = n MgCO3
--> m MgCO3 = 0,1 x 84 = 8,4 gam chiếm 8,4/14,2 = 59,154929%
--> m R(2/a)CO3 = 14,2 - 8,4 = 5,8 gam chiếm 5,8/14,2 = 40,845071%
--> n R(2/a)CO3 = 0,15 - 0,1 = 0,05 mol.
--> PTK của R(2/a)CO3 = 5,8/0,05 = 116.
--> 2M/a = 116 - 60 = 56 hay M = 23a.
Chọn a = 2 với M = 56 --> R là Fe.
b) Khối lượng chất rắn sau khi nung đến khối lượng không đổi là khối lượng của 0,1 mol MgO và 0,05 mol FeO(1,5). (FeO(1,5) là cách viết khác của Fe2O3. Cũng là oxit sắt 3 nhưng PTK chỉ bằng 80).
m chất rắn sau khi nung = (0,1 x 40) + (0,05 x 80) = 8 gam.

a) Đặt nK = a và nAl = b ta có:
39a + 27b = 10,5 (1)
\(K+H_2O\rightarrow KOH+\dfrac{1}{2}H_2\)
a............................a
\(Al+KOH+H_2O\rightarrow KAlO_2+\dfrac{3}{2}H_2\)
b...........b...............................b
Thêm từ từ HCl vào dd A lúc đầu không có kết tủa do HCl trung hòa KOH dư:
\(HCl+KOH\rightarrow KCl+H_2O\)
(a-b)<-----(a-b)
Khi HCl trung hòa hết KOH dư thì xuất hiện kết tủa:
KAlO2 + HCl + H2O → Al(OH)3 + KCl
Để trung hòa hết KOH cần: 0,1. 1 = 0,1 mol HCl
a – b = nHCl = 0,1 (2)
Giải hệ (1) và (2) ta có: a = 0,2 và b = 0,1
=> \(\%m_K=\dfrac{0,2.39}{10,5}=74,29\%\); \(\%m_{Al}=25,71\%\)

3. CuO +H2SO4 -->CuSO4 +H2O
nCuO=64/80=0,8(mol)
theo PTHH :nCuO =nH2SO4=nCuSO4=0,8(mol)
=>mddH2SO4 20%=0,8.98.100/20=392(g)
mCuSO4=0,8.160=128(g)
mdd sau phản ứng =64 +392=456(g)
mH2O=456 -128=328(g)
giả sử có a g CuSO4.5H2O tách ra
trong 250g CuSO4 tách ra có 160g CuSO4 và 90g H2O tách ra
=> trong a g CuSO4.5H2O tách ra có : 160a/250 g CuSO4 và 90a/250 g H2O tách ra
=>mCuSO4(còn lại)=128 -160a/250 (g)
mH2O (còn lại)=328 -90a/250 (g)
=>\(\dfrac{128-\dfrac{160a}{250}}{328-\dfrac{90a}{250}}.100=25\)
=>a=83,63(g)

có n NO = 0,04 mol và dd có axit dư => ko tạo muối amoni
Al : x mol
Fe y mol
=> 27x + 56y = 1,95
3x +3y = 0,04.3
=> x =0,01 , y = 0,03
=> m Al = 0,27g, m Fe = 1,68 g
bạn gọi số mol của Fe(OH)2 : x mol
Fe(OH)3 : y mol
vì sau khi nung chỉ có Fe2O3 và Al2O3
0,015 0,0075
x + y = n Fe = 0,03 mol
n OH- = 4n Al 3+ - n kết tủa
=> 0,165 - 2x -3y = 4.0,03 - 0,015
=> 2x + 3y = 0,06
=> x = 0,03, y = 0 => Al đẩy Fe 3+ xuống Fe 2+ hoàn toàn
=> n Al tác dụng với HNO3 còn lại = 0,01 mol
=> n NO thoát ra = 0,01 mol
=> tổng n NO thoát ra = 0,05 mol
=> n HNO3 = 0,05.4 = 0,2 mol
=> Cm = 1,25 M

\(n_{H_2}=\dfrac{8,96}{22,4}=0,4mol\)
Gọi số mol Fe và Al lần lượt là: x và y
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
x x x x
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
y 1,5y 1,5y
Ta có:
\(\left\{{}\begin{matrix}56x+27y=11\\x+1,5y=0,4\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\%m_{Fe}=\dfrac{0,1.56}{11}.100\%=50,9\%\)
\(\%m_{Al}=100\%-50,9\%=49,1\%\)

Đáp án C.
Fe + CuSO 4 → FeSO 4 + Cu
n Fe = x mol
Khối lượng Fe phản ứng (cũng là khối lượng sắt trong hỗn hợp đầu) là 56x. Khối lượng Cu sinh ra 64x.
CuSO 4 dư nên chất rắn sau phản ứng là đồng :
10 - 56x + 64x = 11 → x = 1/8 mol
m Fe trong hỗn hợp đầu là: 56 x 1/8 = 7g
% m Fe = 7/10 x 100% = 70%
% m C u = 100% - 70% = 30%


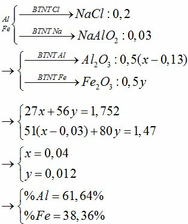

$2Fe + 3Cl_2 \xrightarrow{t^o} 2FeCl_3$
$2Al + 3Cl_2 \xrightarrow{t^o} 2AlCl_3$
$FeCl_3 + 3KOH \to Fe(OH)_3 + 3KCl$
$AlCl_3 + 3KOH \to Al(OH)_3 + 3KCl$
Gọi $n_{Fe} = a(mol) ; n_{Al} = b(mol) \Rightarrow 56a + 27b = 19,3(1)$
$m_{kết\ tủa} = 107a + 78b = 44,8(2)$
Từ (1)(2) suy ra a = 0,2 ; b = 0,3
$\%m_{Fe} = \dfrac{0,2.56}{19,3}.100\% = 58,03\%$
Đáp án C
C