Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(2Al + 6HCl \rightarrow 2AlCl_3 + 3H_2\)
\(n_{Al}= \dfrac{5,4}{27}= 0,2 mol\)
Theo PTHH:
\(n_{AlCl_3}= n_{Al}= 0,2 mol\)
\(\Rightarrow m_{AlCl_3}= 0,2 . 133,5=26,7 g\)
Theo PTHH:
\(n_{H_2}= \dfrac{3}{2} n_{Al}= 0,3 mol\)
\(\Rightarrow V= 0,3 . 22,4= 6,72 l\)
b)
Theo PTHH:
\(n_{HCl}= 3n_{Al}= 0,6 mol\)
\(\Rightarrow m_{HCl}= 0,6 . 36,5=21,9 g\)
\(\Rightarrow m_{dd HCl}= \dfrac{21,9 . 100}{15}= 146 g\) ( nếu ở tử là : 21,9 . 100% thì ở mẫu bạn chia cho 15% nhé)

Đổi 300ml = 0,3 lít
Ta có: \(n_{H_2SO_4}=5.0,3=1,5\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=\dfrac{\dfrac{8\%.400}{100\%}}{171}=\dfrac{32}{171}\left(mol\right)\)
a. PTHH: \(Ba\left(OH\right)_2+H_2SO_4--->BaSO_4\downarrow+2H_2O\)
Ta thấy: \(\dfrac{1,5}{1}>\dfrac{\dfrac{32}{171}}{1}\)
Vậy Ba(OH)2 dư, H2SO4 hết.
Theo PT: \(n_{BaSO_4}=n_{H_2SO_4}=1,5\left(mol\right)\)
\(\Rightarrow m_{BaSO_4}=1,5.233=349,5\left(g\right)\)
b. Không có muối tạo thành

\(a,n_{AlCl_3}=1\cdot0,2=0,2\left(mol\right)\\ m_{Na_2CO_3}=\dfrac{200\cdot6\%}{100\%}=12\left(g\right)\\ \Rightarrow n_{Na_2CO_3}=\dfrac{12}{106}\approx0,1\left(mol\right)\\ PTHH:3AlCl_3+2Na_2CO_3+H_2O\rightarrow2Al\left(OH\right)_3\downarrow+6NaCl+3CO_2\uparrow\)
Vì \(\dfrac{n_{AlCl_3}}{3}>\dfrac{n_{Na_2CO_3}}{2}\) nên sau phản ứng \(AlCl_3\) dư
\(\Rightarrow n_{Al\left(OH\right)_3}=n_{Na_2CO_3}=0,1\left(mol\right)\\ \Rightarrow m_{Al\left(OH\right)_3}=0,1\cdot78=7,8\left(g\right)\\ b,n_{NaCl}=3n_{Na_2CO_3}=0,3\left(mol\right)\\ \Rightarrow m_{NaCl}=0,3\cdot58,5=17,55\left(g\right)\)

1.1. Al + NaOH + H2O ==> NaAlO2 + 3/2H2
nH2(1)=3,36/22,4=0.15(mol)
=> nAl(1)= nH2(1):3/2= 0.15:3/2= 0.1(mol)
2.Mg + 2HCl ==> MgCl2 + H2
3.2Al + 6HCl ==> 2AlCl3 + 3H2
4.Fe + 2HCl ==> FeCl2 + H2
=> \(n_{H_2\left(2,3,4\right)}=\) 10.08/22.4= 0.45(mol)
=> nH2(3)=0.1*3/2=0.15(mol)
MgCl2 + 2NaOH ==> Mg(OH)2 + 2NaCl
AlCl3 + 3NaOH ==> Al(OH)3 + 3NaCl
FeCl2 + 2NaOH ==> Fe(OH)2 + 2NaCl

$Ca(HCO_3)_2 + 2NaOH \to CaCO_3 + Na_2CO_3 + 2H_2O$
Theo PTHH :
$n_{Ca(HCO_3)_2} = n_{CaCO_3} = \dfrac{30}{100} = 0,3(mol)$
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
$2CO_2 + Ca(OH)_2 \to Ca(HCO_3)_2$
Theo PTHH :
$n_{CO_2} = n_{CaCO_3} + 2n_{Ca(HCO_3)_2} = \dfrac{20}{100} + 0,3.2 = 0,8(mol)$
$V = 0,8.22,4 = 17,92(lít)$
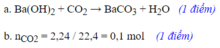
\(a.\left\{{}\begin{matrix}CO_2\\Ca\left(OH\right)_2\end{matrix}\right.\rightarrow CaCO_3\rightarrow Ca\left(HCO_3\right)_2\)
\(b.\) \(n_{CaCO_3}=0,05\left(mol\right)\)
\(PTHH:CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
\(\left(mol\right)\) \(0,05\) \(0,05\) \(0,05\)
\(PTHH:CaCO_3+CO_2+H_2O\rightarrow Ca\left(HCO_3\right)_2\)
\(\left(mol\right)\) \(0,05\) \(0,05\) \(0,05\)
\(\rightarrow V_{CO_2}=22,4.\left(0,05+0,05\right)=2,24\left(l\right)\)
\(c.V_{Ca\left(OH\right)_2}=\dfrac{0,05}{0,1}=0,5\left(l\right)\\ m_{Ca\left(HCO_3\right)_2}=0,05.162=8,1\left(g\right)\\ C_{M_{Ca\left(HCO_3\right)_2}}=\dfrac{0,05}{0,5}=0,1\left(M\right)\)
\(d.V_{CO_2}=0,05.22,4=1,12\left(l\right)\\ m_{\downarrow}=5\left(g\right)\)
a) Dẫn từ từ CO2 đến dư vào dung dịch Ca(OH)2 xảy ra phản ứng:
CO2 + Ca(OH)2 → CaCO3 + H2O
CO2 + CaCO3 + H2O → Ca(HCO3)2
Hiện tượng quan sát được: Dung dịch xuất hiện kết tủa trắng tăng dần đến cực đại, sau đó kết tủa tan dần đến hết.
b)\(n_{CaCO_3}=\dfrac{5}{100}=0,05\left(mol\right)\)
CO2 + Ca(OH)2 → CaCO3 + H2O
0,05<---0,05------------0,05
CO2 + CaCO3 + H2O → Ca(HCO3)2
0,05<----0,05-------------------->0,05
Theo PT ta có : \(n_{CO_2}=2n_{CaCO_3}=0,1\left(mol\right)\)
=> \(V_{CO_2}=0,1.22,4=2,24\left(l\right)\)
c)Theo PT ta có : \(n_{Ca\left(HCO_3\right)_2}=n_{CaCO_3}=0,05\left(mol\right)\)
=> \(m_{Ca\left(HCO_3\right)_2}=0,05.162=8,1\left(g\right)\)
Theo PT ta có : \(n_{Ca\left(OH\right)_2}=n_{CaCO_3}=0,05\left(mol\right)\)
\(V_{Ca\left(OH\right)_2}=\dfrac{0,05}{0,1}=0,5\left(l\right)\)
Giả sử thể tích dung dịch thay đổi không đáng kể:
=> \(CM_{Ca\left(HCO_3\right)_2}=\dfrac{0,05}{0,5}=0,1M\)
d) Trường hợp chỉ tạo ra kết tủa :
CO2 + Ca(OH)2 → CaCO3 + H2O
Theo PT : \(n_{CO_2}=n_{CaCO_3}=n_{Ca\left(OH\right)_2}=0,05\left(mol\right)\)
=> \(V_{CO_2}=0,05.22,4=1,12\left(l\right)\)
\(m_{CaCO_3}=0,05.100=5\left(g\right)\)